发布日期:2025-9-17 10:54:19
1、引言
钛因其良好的生物相容性、耐腐蚀性、低密度已作为牙种植体广泛用于替代缺失的牙齿,Ti6Al4V因其更好的机械性能也是纯钛的理想替代品[1]。实际应用中牙种植体周围的骨组织通过骨重塑来适应机械负荷[2]。然而,钛及其合金(110GPa)的弹性模量相比于骨骼(10~30GPa)过高,从而导致金属植入物和骨组织间的“应力屏蔽”效应,进而引发骨结合不良和植入物松动[3]。此外,Ti6Al4V在口腔种植后会释放有毒的Al和V金属离子,危害人体健康[4–5]。因此,锆合金因其优异的耐腐蚀性、良好的力学性能、在体内可形成骨状磷灰石层以及具有较低磁化率,作为骨科植入替代材料受到越来越多的关注[6]。目前对植入锆合金的研究主要围绕添加β相稳定元素以获得弹性模量更低的含β相锆合金,研究较为广泛的医用锆合金包括Zr-Ti系及Zr-Nb系[7–9]。对于ZrTi系合金,Zr和Ti2种元素属于同一主族,具有相似的物理化学性质和晶体结构,并且可以形成无限固溶体,十分便于进行合金成分设计。Hsu等人[10]对比了铸态Zr-xTi(x=10,20,30,40,wt%)合金的力学性能,发现Zr-Ti合金不仅抗弯强度高于纯锆,还具有良好的延展性;弹性模量 范围在68GPa(Zr-30Ti)至78GPa(Zr-40Ti),显著低于纯钛,有望成为新型口腔种植材料。当Zr和Ti的原子比接近1:1时(Zr-30wt%Ti),固溶强化的效果最大[11]。对于Zr-Nb系合金,Zr和Nb是同一周期相邻元素,β-Nb和β-Zr晶体结构相同,点阵参数和原子半径相近,因此Zr-Nb合金的点阵畸变小,相应地弹性模量较其他体系更低。
Nb是锆合金最常用的β相稳定元素,当Nb含量大于22wt%时合金可由单一β相组成,兼具较低的弹性模量和高延展性及适度的强度[12]。尽管已有较多对于新型医用锆合金作为骨科和牙科材料的研究,并进行了相关的体外测试[6,13],但距离真正的临床应用还需要更深入的研究和审查。
由于外部载荷形成的应力应变控制着人体骨组织的力学响应,生物力学的影响对于预测成功植入具有重要作用。临床应用中,植入物面临复杂的生物力学问题,而采用复杂的活体实验很难去了解生物力学过程[14]。动物研究可以直接观察到骨组织对种植体植入后的应力表现出的生物力学反应,但很难评估内部的应力应变。尽管一些实验的方法,如应变仪,可以精确控制载荷的大小来评估表面应变,但无法评估应变仪之外的区域[15]。因有限元方法是模拟宏细观材料力学性能演化的有效方法,在生物医学领域有着广泛的应用[16–17]。有限元作为一种数值模拟方法,允许研究者在进行体内实验之前对所研究的问题进行初步评估,可用于观察种植体及骨组织的应力应变分布及细节,从而研究种植体材料的生物力学性能,预测骨组织的生物力学行为。在实现研究向临床应用转化的漫长过程中,有限元方法加速了进程并提供深入细致的研究结果及规律。因此,有限元分析在牙科材料的选择中起到重要作用,并且在其他新型替代材料(如PEEK、氧化锆)的生物力学性能研究得到较多的应用[17–19]。然而,在种植牙的生物力学行为研究中,生物体的复杂性和动态性使得使用计算机无法完全复制每个细节[20]。因此采用静态加载的方式对植入物和骨组织的强度和稳定性进行分析及初步评估植入物应用的可行性,同时减少了计算的复杂性。在新型生物医用锆的牙科种植体研究中同样应当进行模拟真实口腔环境的生物力学性能研究,以对其应用潜力进行全面评估。考虑到实际咀嚼食物过程中牙齿的运动规律主要包括轴向的压碎运动和侧向的磨碎运动,作用在牙齿上的载荷相应地有垂直载荷和倾斜载荷[21]。因此,本研究采用三维有限元方法模拟2种锆合金种植体在垂直和倾斜两种载荷条件下的应力分布,并与传统较高弹性模量的Ti6Al4V、更低弹性模量的一种锆合金[22]进行对比分析,研究种植体弹性模量变化对力学性能的影响,从而为这类合金的应用补充相关数据。
2、实验
基于本课题组的研究,制备了Zr-30(wt%)Ti合金。合金的制备工艺过程如下:采用真空非自耗电弧炉熔炼得到约60g的铸锭。为保证合金成分的均匀性,将锭子反复重熔6次。合金锭经热压(650℃)、热轧(650℃)、真空淬火(650℃,保温15min)获得1.2mm厚的板状样品。
淬火态样品参照《GB/T228.1-2021金属材料拉伸试验第1部分:室温试验方法》进行拉伸试验。首先,使用线切割得到3组拉伸平行样,将切割得到的淬火态样品依次使用400#、800#、1200#、1500#和2000#的砂纸进行打磨以及酒精超声清洗。烘干后的样品在室温下进行拉伸,拉伸速率为6mm/min,拉伸过程中使用引伸计,结果作为种植体材料属性参数。
参照士卓曼(Straumann)种植系统,使用Solidworks软件建立种植体系统模型,包括基台、种植体、骨组织(种植体简称为IM)。尽管目前主流的种植牙结构是两段式[22‒23],为了减少潜在失效的多样性,本研究种植体的几何模型采用一段式且仅考虑材料特性的影响。针对下颌磨牙的骨内种植治疗,选取标准ITI(InstituteStraumann,Waldenburg,Switzerland)种植体为参照,种植体的几何参数如图1所示。种植体相关参数如表1所示。
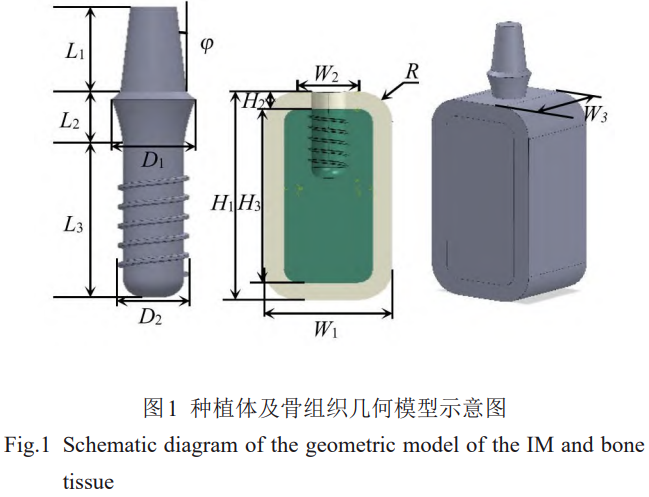
骨组织由皮质骨和松质骨组成,内部是松质骨,外部覆盖一层厚度H2=2mm的皮质骨(皮质骨简称为CO,松质骨简称为CA)。骨组织的建模仿照下颌骨截面,并将其近似为方形,但具体的几何尺寸则参考临床的统计数据[24],如表1和图1所示。
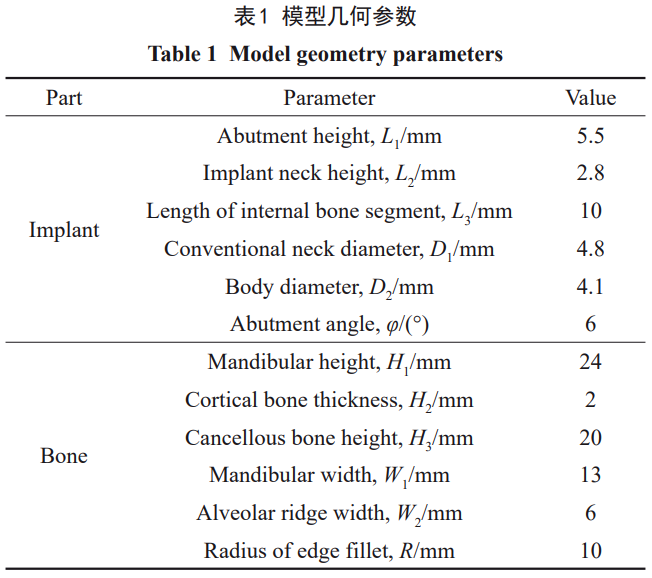
对于骨内种植体材料,考虑到处于较小的应变状态,可近似为各向同性、均匀线弹性模型[25]。本研究计算所使用的材料中以Ti6Al4V和Zr24Nb作为对照材料,材料参数取自文献[19,22],以做更全面的分析。Zr22Nb材料参数来自本课题组工作,各种植体材料的属性如表2所示。为方便表达,后文均以1#、2#、3#和4#来代表Ti6Al4V、Zr30Ti、Zr22Nb和Zr24Nb各种植体模型。
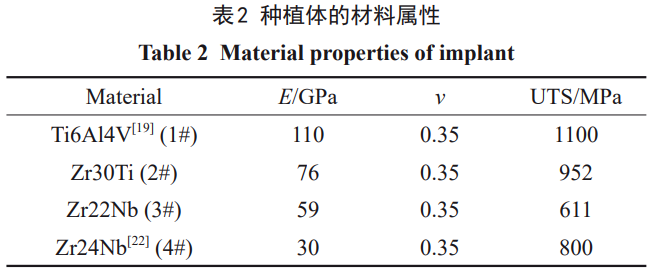
下颌骨的材料属性显著影响其对外部载荷的力学响应。由于径向和切向的弹性模量相近并且明显小于纵向,故可认为骨组织材料属性为正交各向异性[25]。对于正交各向异性材料,默认材料至少有2个正交的对称平面,并且材料属性独立于每个平面的方向,因此骨组织的材料本构中有9个弹性常数,具体形式为[26–29]:
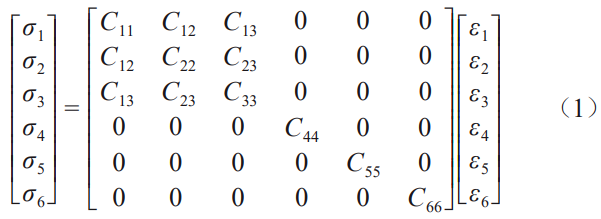
对于正交各向异性材料,弹性模量分量和弹性常数之间存在定量关系[30‒31]:
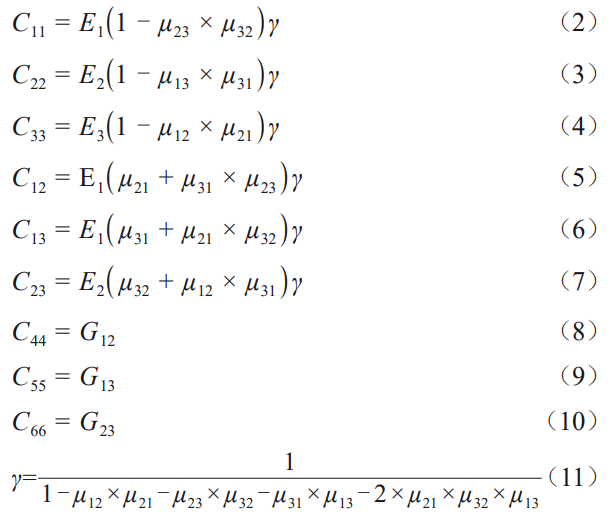
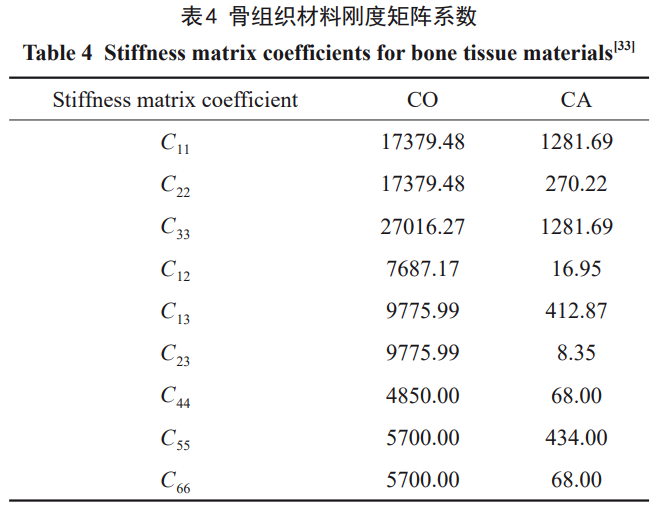
由表3中的骨组织材料参数(表中弹性模量和泊松比的下标x、y、z与上式中的下标1、2、3对应,同时与模型的坐标系相对应)可计算出骨组织的刚度系数并用于计算,如表4所示。
由于种植体系统由多个部件组成,装配体之间存在多个相互配合的接触界面。对于本研究,接触界面主要为种植体-骨界面、皮质骨-松质骨界面。为了模拟种植体植入后的长期性能,假定种植体和骨组织之间实现完全的骨结合,本研究将皮质骨和松质骨模型间的接触类型设置为绑定约束(Tie),即假定骨组织间不发生相对位移。选取大小为250N的载荷,施加于假设为咬合接触面的种植体基台组合模型顶部[34‒35]。加载方向有2种:
沿种植体轴向;沿颊舌向(模型中的x轴方向),倾斜角度参考ISO14801牙科植入物疲劳测试标准,选取为30°。加载方向与网格示意图见图2。
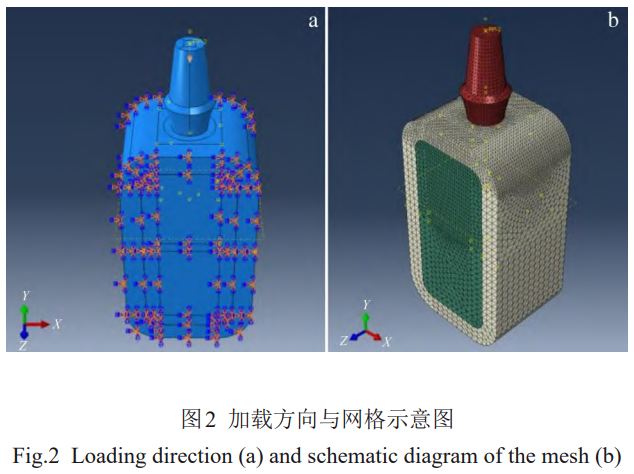
基于二次四面体单元对模型进行网格划分,通过网格优化确定骨组织网格尺寸约为1mm,种植体网格尺寸约0.3mm。对接触界面网格进行优化,确定接触界面处种植体部分网格尺寸为0.2mm,骨组织部分网格尺寸为0.15mm。模型网格单元数如表5所示。
3、实验结果
3.1 种植体及骨组织的应力分布
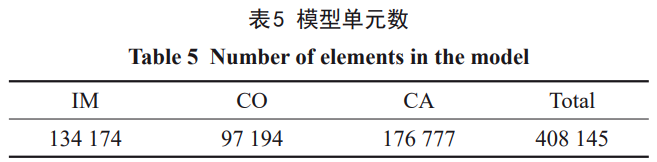
垂直载荷下各组模型中种植体的Mises应力分布如图3所示,应力分布趋势相似,应力集中与最大应力位置均为种植体颈部区域。同样,各组模型中皮质骨和松质骨具有相似的应力分布。皮质骨与松质骨上表面边缘均存在应力集中,松质骨的第一螺纹处相较其他位置也表现出较高的应力。相比其他材料,仅弹性模量为30GPa的4#模型(Zr24Nb)在骨组织出现一定的应力分布区扩大。
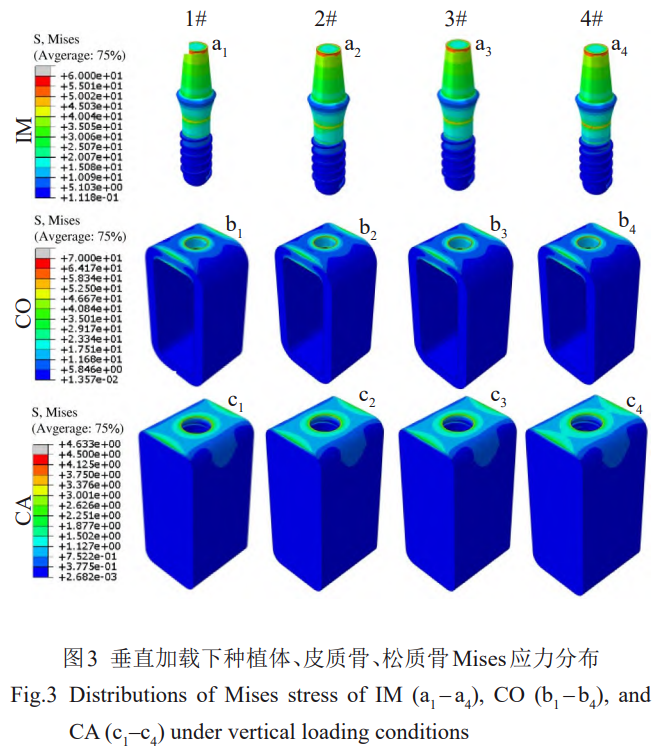
各模型结果的差异主要表现在最大应力值。如表6所示,垂直加载条件下,1#(110GPa)、2#(76GPa)、3#(59GPa)、4#(30GPa)种植体的最大应力分别为75、77、79、85MPa,在皮质骨中产生的最大Mises应力分别为86、89、91、98MPa,在松质骨中产生的最大Mises应力差别不大,分别为4.63、4.57、4.51、4.23MPa,种植体传递的应力主要由皮质骨承受。种植体和皮质骨的应力集中程度和最大应力值均随着弹性模量的降低而增加,松质骨则呈现相反的趋势。
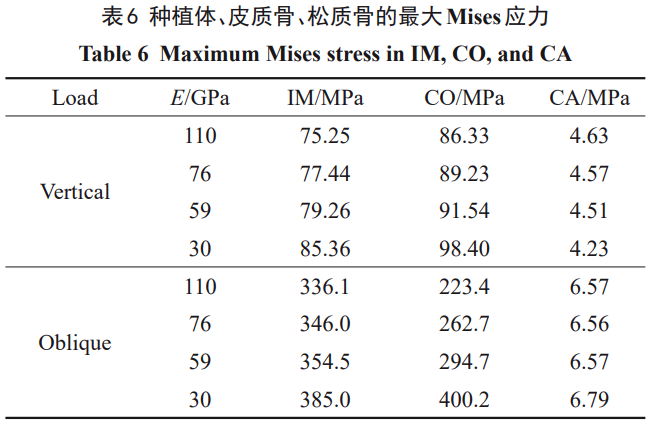
倾斜载荷下各组模型的应力分布相似(图4)。骨组织应力明显集中在一侧,种植体则在沿加载方向的两侧均存在应力集中。1#种植体的颈部应力区可达到第三螺纹,2#、3#则在第二、三螺纹间,4#仅在第一螺纹。同时,1#、2#、3#、4#种植体在倾斜载荷下的最大应力分别为336、346、355、385MPa。随着植入材料的弹性模量降低,种植体颈部的应力集中程度增加。
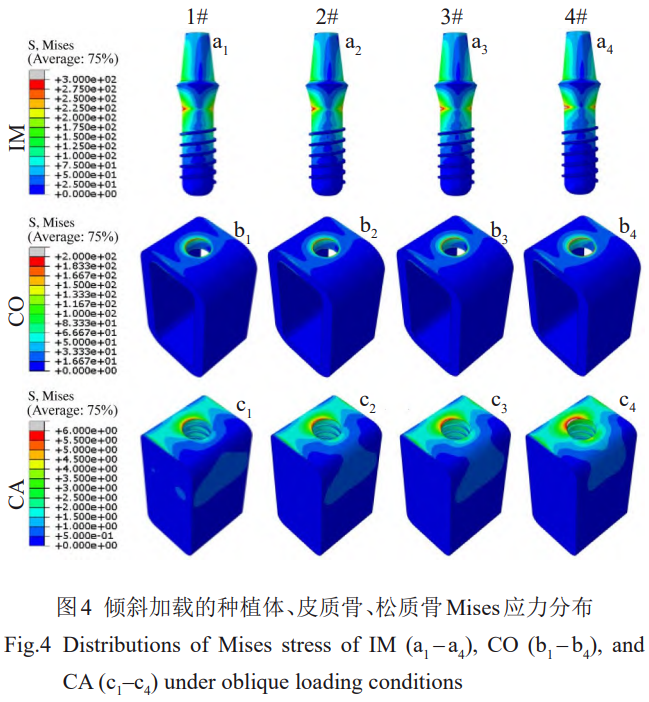
对于种植体在皮质骨内表面产生的大于50MPa的应力区范围,1#产生的相应应力区大小约为皮质骨厚度的1/2,2#产生的相应应力区大小约等于皮质骨厚度,3#和4#产生的相应应力区进一步横向扩大。对于松质骨表面大于2MPa的应力区,相比于1#,2#、3#、4#种植体产生的应力区明显扩大。对于松质骨植入位置螺纹间内表面,2#、3#、4#的应力(2~3MPa)的范围逐渐扩大。如表6所示,与垂直载荷的规律相同,种植体和皮质骨的最大应力值随着弹性模量的降低而增加。然而,1#、2#、3#、4#种植体在松质骨产生的最大应力值分别为6.57、6.56、6.57、6.79MPa,则是先减小后增加,种植体弹性模量为76GPa时最小。在2种载荷条件下,骨组织中的应力主要由皮质骨承担。倾斜加载在种植体和皮质骨所产生的最大应力要明显高于垂直加载,各种植体的最大应力约为垂直载荷下的4.5倍,1#、2#、3#及4#模型中皮质骨的最大应力约为垂直载荷下的2.6倍、2.9倍、3.2倍、4.1倍,应力增加幅度逐渐增大。
不论是垂直加载还是倾斜加载,颊舌向(模型中的x轴方向)的应力在路径A-B的前3个节点内迅速降低,这是由于在接触面使用了不发生相对位移的绑定约束从而导致第1个单元内的应力梯度较大,得到的结果较为保守。然而,应力在经历较为迅速的降低后逐渐趋于平缓。
垂直载荷下,皮质骨在颊舌向路径A-B的第3个节点后的应力范围为5~25MPa;倾斜载荷下,皮质骨在颊舌向路径A-E的第3个节点后的应力范围为0~80MPa;并且种植体弹性模量的降低使得皮质骨应力有所增加(图5b、5e)。相比于颊舌向,近远中方向(模型中的z轴方向)的应力变化整体较为和缓,垂直加载(路径C-D)和倾斜加载(路径C-F)的应力均小于100MPa,倾斜加载产生的最大应力(位置C)仅比垂直加载高约13%(图5c、5f)。
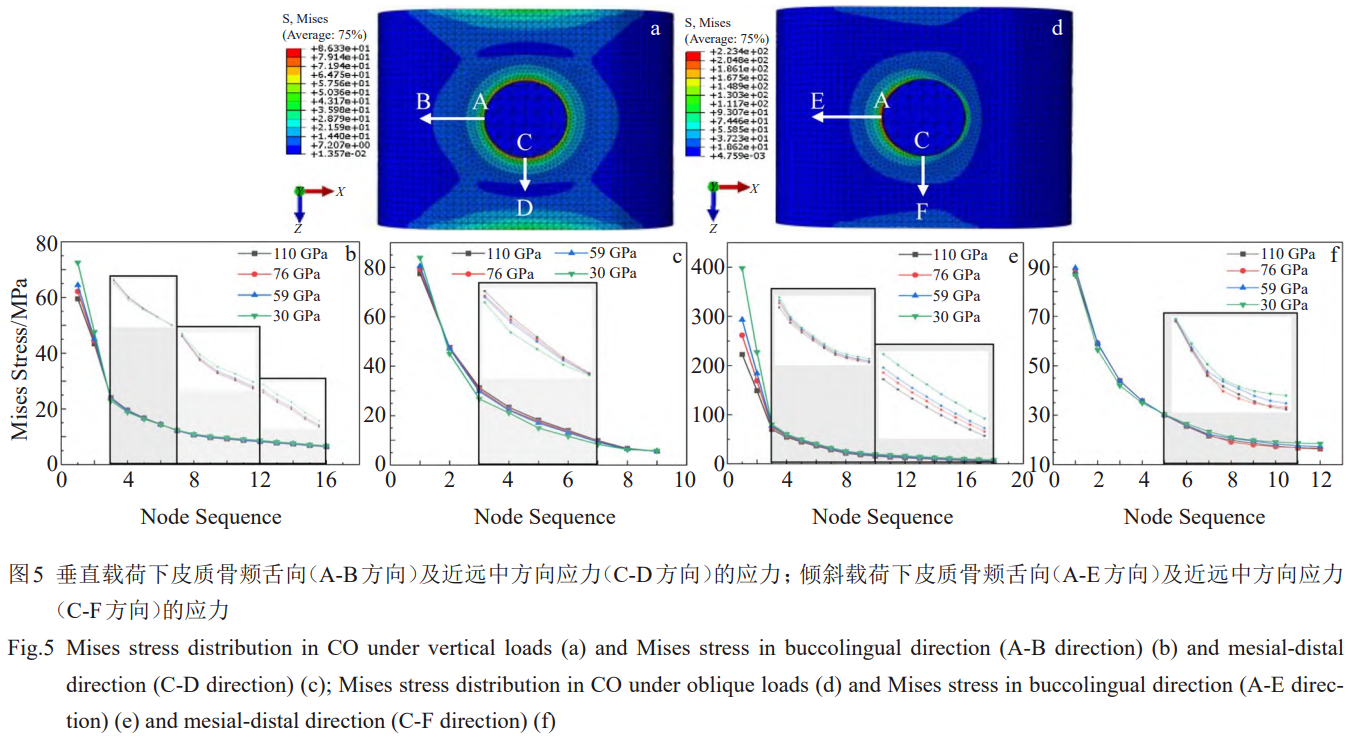
然而,倾斜加载在颊舌向产生的最大应力(位置A)比垂直加载高2.7~4.5倍。一方面,2种加载条件下的应力集中位置不同,垂直加载时应力集中处位于近远中方向(位置C),而倾斜加载时则位于颊舌向(位置A);另一方面,垂直加载时应力在皮质骨植入部位边缘的分布相比于倾斜加载更为均匀,倾斜加载时应力集中在皮质骨的一侧,因此这种载荷工况对于皮质骨是一种更为恶劣的情况,但种植体应依然保持良好的性能,以适应实际口腔应用中可能出现的不良载荷条件。然而,对于皮质骨表面的应力变化,各模型间的差异较小,明显的差异主要在于皮质骨与种植体接触界面以及皮质骨最大应力,产生差异的原因可能是由于皮质骨表面为自由表面,而皮质骨与种植体间存在完全约束的接触。
3.2 种植体及骨组织的最大应力分析
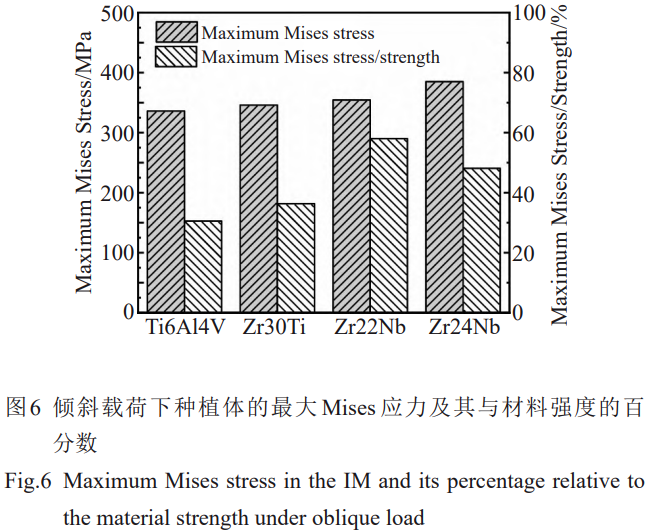
在倾斜载荷下,种植体的最大应力较高,并随着模量的降低应力相应增加,但均小于各材料的抗拉强度,且最大应力占其强度的百分比均小于60%(图6)。2种载荷条件下,最大Mises应力均随着弹性模量的降低而增加,并且倾斜载荷下的变化更为明显(图7a、7d)。考虑到骨组织可近似为脆性材料[31],当最大主应力达到或超过材料的抗拉强度或抗压强度时,脆性材料往往会发生突然破坏,因此对皮质骨的最大主应力进行分析。2种载荷条件下,皮质骨中的最大压应力值均大于最大拉应力值。
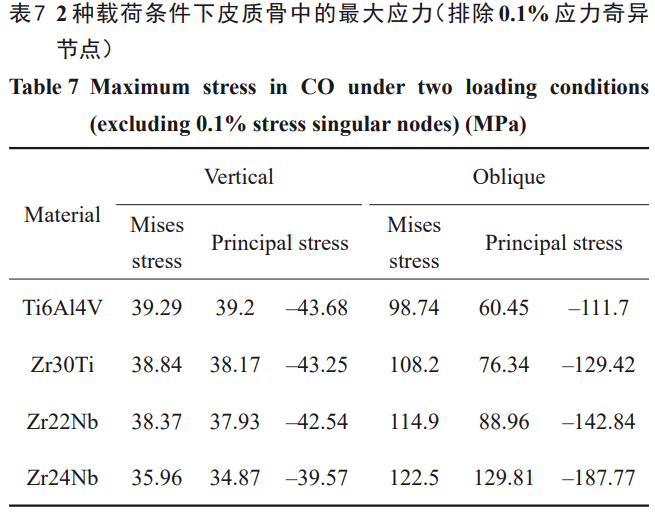
垂直载荷下,最大拉压应力范围为–150~100MPa;倾斜载荷下,最大拉压应力范围为–700~500MPa(图7b、7e)。由前述对Mises应力的分析表明,在皮质骨植入部位的边缘存在较大的应力集中,这是由于几何模型在此处为直角,存在奇异点(即计算应力值趋于无穷大)。为了克服计算问题并得到更具代表性和真实性的结果,在排除了0.1%的奇异节点后对最大主应力进行了统计。垂直载荷下,相比于1#,2#、3#、4#种植体在皮质骨的最大Mises应力略有降低,最大Mises应力范围为35.96~39.29MPa,最大拉压应力范围为–43.68~–39.20MPa;倾斜载荷下,2#、3#、4#种植体在皮质骨产生的最大Mises应力相比于1#增加,最大Mises应力范围为99~123MPa,最大拉压应力范围为–188~130MPa(图7b、7e)。垂直载荷和倾斜载荷下皮质骨的最大Mises应力均随弹性模量的降低而增加并呈现轻微的非线性特点。
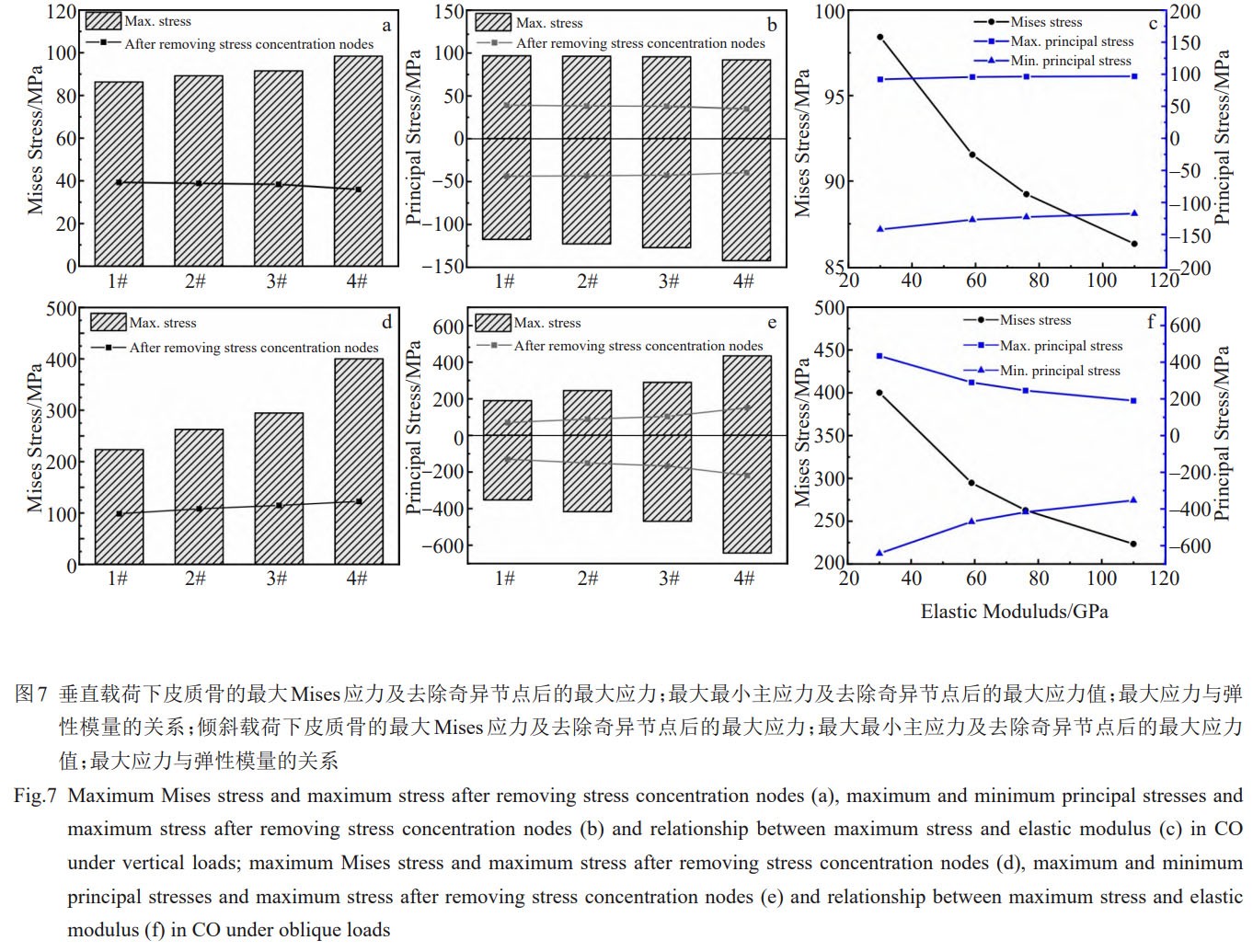
对于皮质骨中的主应力,最大压应力值随着植入材料弹性模量的降低而增加,最大拉应力值在垂直加载时随着弹性模量增加而减小,倾斜加载时则随弹性模量的增加而增加(图7c、7f)。这是由于2种载荷条件下皮质骨的最大拉应力位置不同,如图8c1~8c4和图9c1~9c4所示。
3.3 种植体弹性模量对种植体-骨界面应力的影响
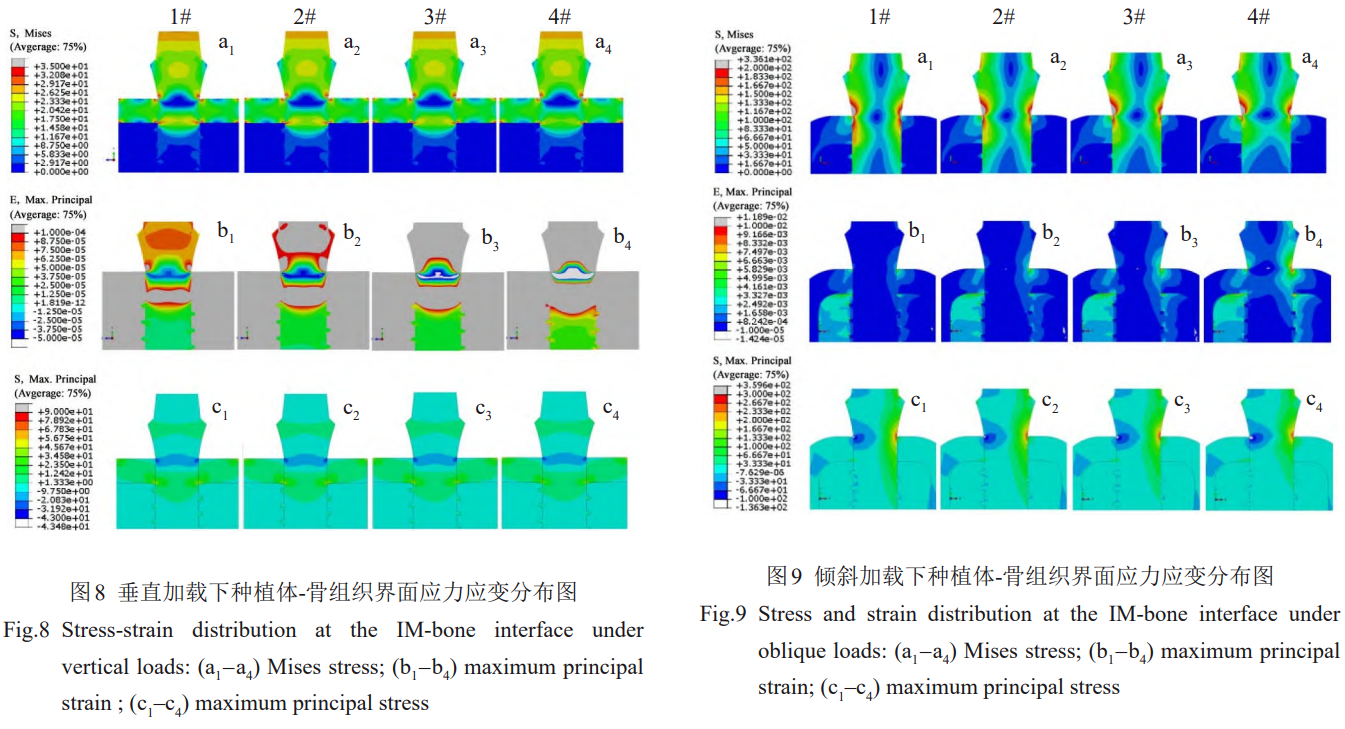
垂直加载时,种植体-皮质骨界面处的应力集中位于皮质骨上下两端,同时是皮质骨发生几何突变的位置。皮质骨上端应力集中处的Mises应力是皮质骨中的最大值,随着弹性模量的减小而增加。1#、2#、3#、4#种植体在皮质骨下端的最大Mises应力值分别为71、68、62、60MPa,随着种植体弹性模量的降低而逐渐减小。
对于与皮质骨下端接触的种植体内部,大于23MPa的应力区横穿种植体,2#、3#种植体内该应力区范围逐渐缩小,4#种植体内该应力区已不明显(图8a1~8a4)。对于最大主应力的分布,各模型间没有明显差别,但最大拉压应力均随着弹性模量的降低而增加(图8c1~8c4)。各种植体内部应变均为压应变,1#、2#、3#、4#种植体内部的应变分别约为–2.9×10-5、–4.8×10-5、–6.8×10-5、–1.2×10-4,压应变随着弹性模量的降低而增加(图8b1~8b4)。
倾斜加载时,皮质骨中应力集中区域主要位于上端,并且该区域大于50MPa的应力区明显随着种植体弹性模量的降低而扩大。同时,种植体两侧大于150MPa的高应力区随着种植体弹性模量的降低明显缩小,应力集
中程度增加(图9a1~9a4)。种植体两侧的最大拉压应力同样随着种植体弹性模量的降低而增加,3#、4#种植体内部大于100MPa的压应力区表现出扩大趋势(图9c1~9c4)。2#、3#、4#种植体的内部出现最大主应变值大于1×10-5的压应变区,3#种植体内最大主应变值大于1.7×10-3的应变区出现横向扩大的趋势,4#种植体内该应变区已在种植体内部横向分布。1#、2#、3#、4#种植体的内部最大主应变分别为–1.4×10-5、–2.8×10-5、–3.7×10-5、–6.9×10-5,倾斜载荷下2#、3#和4#种植体颈部内的最大应变分别是1#的2倍、2.6倍、4.9倍。
垂直载荷下,1#、2#、3#、4#种植体在种植体-皮质骨界面的皮质骨上下两端排除边缘应力集中单元后的应力差大小分别约为10.7、10.8、11、11.7MPa,相应种植体上下两端的应力差大小约为13.2、7.7、7.8、9.0MPa。当植入材料为Ti6Al4V时,种植体-皮质骨界面两侧的应力差十分明显。当植入材料的弹性模量降低时,界面应力差明显减小,且2#、3#、4#模型的整体应力值相较于1#模型减小显著。然而,对4#模型(E=30GPa),界面两侧皮质骨和种植体的应力相比于2#(E=76GPa)和3#(E=59GPa)模型均有所增加(图10b)。
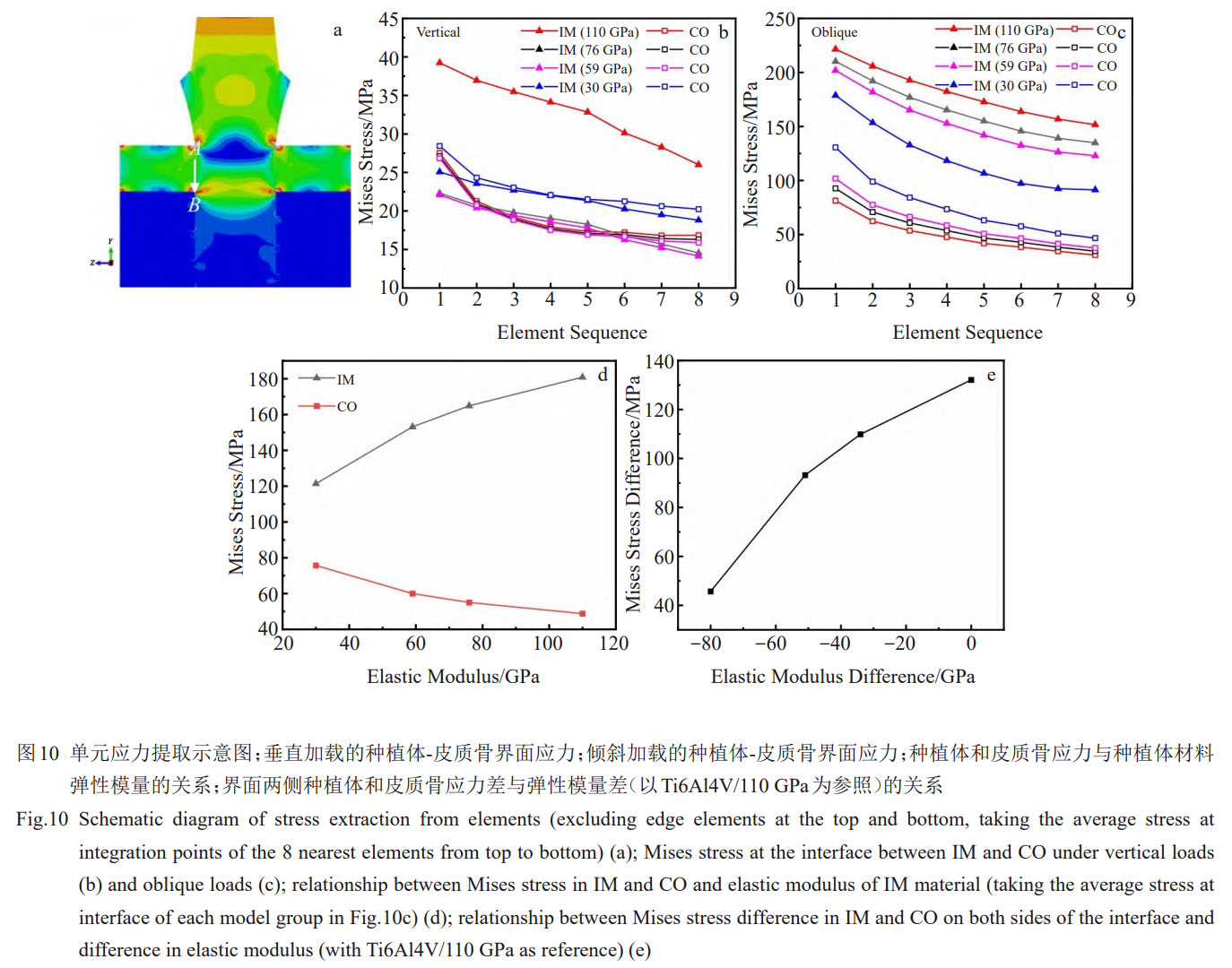
倾斜载荷下,随着植入材料弹性模量的降低,界面的种植体一侧应力减小,骨组织一侧应力增加,界面两侧的应力差明显减小(图10c)。1#、2#、3#、4#种植体-骨界面处的种植体平均Mises应力值分别为181、165、153、121MPa,皮质骨的平均Mises应力分别为49、55、60、76MPa,种植体和皮质骨的应力差分别为132、110、93、46MPa。种植体和皮质骨的应力变化随弹性模量的降低变化趋势不同,种植体应力降低而皮质骨应力增加,界面两侧的应力差相应降低,界面上的平均应力及界面两侧应力差随种植体弹性模量的变化而呈明显的非线性变化(图10d、10e)。
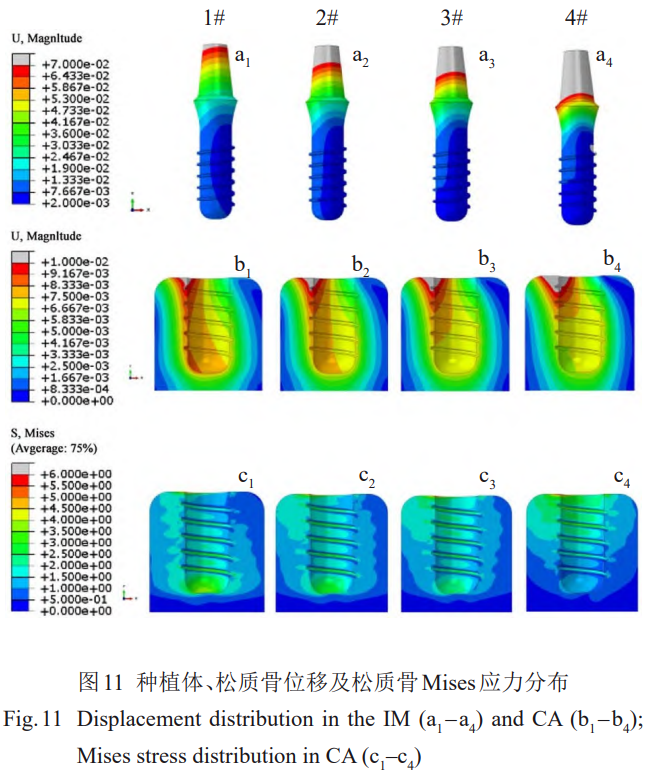
倾斜载荷作用下,随着种植体材料弹性模量的降低,种植体的高位移区逐渐向颈部移动,种植体骨内段的位移分布均匀性降低(图11a1~11a4)。1#、2#种植牙植入的松质骨受压侧内表面位移大于7.5×10-3mm,随着种植体弹性模量降低该区域向受压侧颈部收缩,最大位移增加,但松质骨植入部位底部的位移随着种植体弹性模量的降低而减小,3#、4#种植体在松质骨底部产生的位移已小于7.5×10-3mm(图11b1–11b4)。1#模型种植体在松质骨内产生的Mises应力区主要是受压侧和受拉侧下部分,下端螺纹和底部应力较大;当种植体材料弹性模量减小到30GPa(4#)时,应力区主要位于松质骨上侧,下端螺纹和底部应力较小;螺纹间的应力分布由从底部向顶部减小变为从底部向顶部增加。1#、2#、3#、4#种植体植入位置上下两端松质骨的应力差约为2、3.5、3.5、5.8MPa,植入位置第一螺纹两侧的松质骨应力差约为2、1.5、1.5、1MPa,在各组模型中,2#与3#模型的种植体在松质骨中产生更均匀的整体应力分布(图11c1~11c4)。
4、讨论与分析
本研究采用有限元方法研究了Ti6Al4V和新型生物医用锆合金用作一件式种植体及相应骨组织的应力状态,以评估锆合金用作牙科植入材料的应用潜力。根据材料力学,种植义齿可简化为单端固定的悬臂梁,其中骨组织给予其固定的约束力。其自由端施加的横向载荷分量使其固定端拥有最大的弯矩。纯弯曲的一维等截面梁的刚度为:
k=EA/L(12)
其中,E为弹性模量,A和L分别是梁的截面积和长度。
几何模型相同的条件下,种植体弹性模量对其生物力学的影响本质上也是对其刚度的影响。刚度反映了构件抵抗弹性变形的能力,是力-位移曲线的斜率。故而,较低模量的种植体自由端的位移较大,高位移区向种植体颈部扩大,进一步使得弹性模量较低的材料在颈部变形较大,从而在颈部及周围骨组织中产生较高的应力,并且皮质骨承担了骨组织中的绝大部分应力,这一现象与大多数文献相似[18,36‒38]。这也是多数研究专注于种植体及其部件几何结构的原因。若要改善低模量材料的抗变形能力,增大其直径是一种行之有效的方法,尤其是与皮质骨接触的位置。对于种植体的应力集中部位,据其他研究报道,较为常用的两段式种植牙的应力集中位置同样为种植体的颈部[35‒41]。此外,体外实验表明,不论是一段式还是两段式种植体,断裂均发生在种植体的颈部区域[42‒43]。由此可以推断种植体颈部的应力集中是由其悬臂梁的结构特性所决定的,也是种植体失效的关键位置。
根据Tretto等[37]对钛替代材料用作一段式和两段式种植牙的生物力学行为相关研究,将弹性模量低于种植体的材料用作基台将会促进力向种植体的传递,在相同的钛基台下,两件式种植体的应力要小于一件式。因此,本研究采用的一段式种植体模型得到的应力要高于使用钛基台的情况,评估结果相对较为保守。
在种植体的应力状态分析中可以看到,4种材料的种植体应力集中均位于颈部与皮质骨上表面边缘接触的地方,这可能是因为模型中使用的绑定约束限制了骨组织和种植体之间的相对运动,却不影响种植体上端未约束部分的变形。相比于同样大小的垂直载荷,倾斜载荷作用下弹性模量较低的种植体更易产生较大的应力。
Korabi等[44]虽然使用了允许接触面相对滑动的摩擦接触,但其结果表明弹性模量较低的材料承载能力仍然较差;在横向载荷的作用下,相比于钛及更高模量的材料更易发生破坏,垂直载荷下的承载能力并不受种植体弹性模量的显著影响。然而,在一个咀嚼周期中,种植义齿需要承受相当一部分时间的倾斜载荷,这一点在相关的疲劳研究中得到充分体现[45‒46]。因此,较低模量的种植体在倾斜载荷下的力学性能是十分重要的。本研究结果显示4种种植体的最大Mises应力并未超过其极限强度,锆合金在具有低于钛的弹性模量的同时具有足够的力学性能。
Frost等人[47]基于大量医学相关基础研究建立了应力刺激与骨组织的反馈,当作用在骨组织上的Mises应力为20~60MPa时,应力刺激骨生长;当作用在骨组织上的Mises应力为60~120MPa时,骨组织因过载造成病理性骨吸收;超过120MPa时,骨组织可能会发生断裂。所以对植入材料的应用评估还需包括骨组织的安全性。去除奇异节点后,垂直加载下钛种植体在皮质骨产生的Mises应力约为39MPa,倾斜加载下的Mises应力为98.74MPa。根据临床研究,超负荷是种植体周围表面的边缘骨质流失的主要原因之一,而皮质骨易受超负荷影响,因此临床随访患者口腔中种植体的骨质流失开始于皮质骨并逐渐向松质骨扩大,最终引发并发症影响种植体的稳定性[48‒49]。同样地,本研究结果显示,1#模型的种植体在皮质骨会造成病理性骨吸收,这与临床上发生的钛种植体周围骨边缘存在骨吸收的情况一致,但目前骨吸收是不可避免且轻微骨吸收是可接受的[9,50‒51]。垂直加载时,2#、3#种植体在皮质骨产生的最大Mises应力分别为39和38MPa;倾斜加载时,最大Mises应力为108和115MPa。然而,4#种植体(30GPa)倾斜加载时在皮质骨产生的应力为123MPa,该应力大小在发生断裂的边缘(见表7)。相比之下,2#(76GPa)和3#(59GPa)种植体仍在安全使用范围内。考虑到骨组织的脆性,拉应力超过屈服强度会导致种植失败[52],因此对皮质骨的最大拉压应力也进行了分析。排除应力奇异节点后,垂直加载时钛在皮质骨产生的拉压应力最大,分别为39和–44MPa;倾斜加载时,4#(30GPa)种植体在皮质骨产生的拉压应力最大,分别为130和–188MPa,同样已经非常接近骨组织的拉伸和压缩强度,然而2#(76GPa)和3#(59GPa)在皮质骨产生的最大拉压应力分别为76、–129和89、–143MPa,均低于皮质骨的强度(抗拉强度为130MPa,压缩强度为190MPa[18])(见表6)。从Mises应力和主应力2种应力评估结果看,2#(76GPa)和3#(59GPa)种植体具有良好的使用安全性。尽管如此,需要强调的是种植体较低的弹性模量在倾斜加载时会引起应力的增加,使得种植体颈部及周围皮质骨的过载风险增加。
目前,牙科植入物的研究致力于减弱“应力屏蔽”效应的影响,即期望骨组织受到更多的应力刺激,实现更好的骨结合。理想的种植体材料应当实现良好的载荷传递,减小种植体-骨界面应力差[14]。在两种加载方向下,随着弹性模量的降低,皮质骨上端的应力集中及最大应力值增加,而底部的应力变化情况则相反。Piotrowski等[22]对Zr24Nb在垂直载荷下的有限元生物力学模拟中出现了与本研究相同的现象,但皮质骨界面上端并未出现应力集中。这是由于Piotrowski等的几何模型中种植体植入骨组织的位置较深,种植体颈部完全位于骨组织中,皮质骨上端和种植体的接触面积较大,刚度也更大。
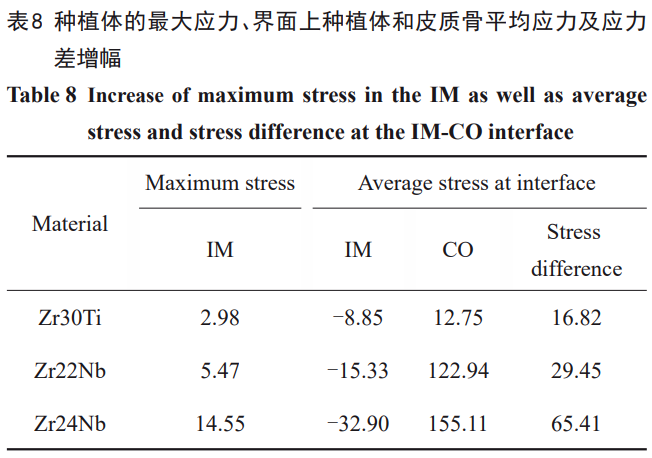
然而,皮质骨底部应力分布的改善本质上仍与材料弹性模量相关。在相同的载荷条件下,较“柔软”的低模量材料更易发生变形,因此在皮质骨底部的几何不连续处产生更大的变形,另一方面,种植体和骨组织的模量差减小,变形更为协调,界面两侧的应变差更小、应变区分布相对更为均匀。此外,材料泊松比相同的情况下,较低模量种植体在与皮质骨上端接触位置内部的较大应变沿横向分布。这是由于种植体发生了压缩变形,垂直载荷下内部应变区向下扩大,横向载荷分量下表现为明显的应变横向扩大,从而促使种植体在皮质骨区域内的整体应变增加,有利于应力向皮质骨的传递。由于变形协调性增加,皮质骨界面上平均应力增加的同时种植体的平均应力减小,进而界面的应力差非线性减小。以1#种植体作为标准,倾斜载荷下对于种植体最大Mises应力,2#、3#、4#种植体的应力增幅分别为2.98%、5.47%、14.55%,但最大应力仍小于其强度(分别为952、611、800MPa)(见表2);对于界面种植体的平均Mises应力,相应的应力降低幅度分别为8.85%、15.33%、32.90%;对于界面皮质骨的平均Mises应力,相应的应力增幅分别为12.75%、122.94%、155.11%,其最大应力增幅分别为17.59%、31.92%、79.14%;对于界面的应力差,相应的应力降低幅度分别为16.82%、29.45%、65.41%(见表8)。由此可见降低弹性模量对于促进应力向骨组织的传递效果非常明显。虽然种植体的应力增加幅度较小,但材料的强度还是一个重要的判断标准,其中2#和3#种植体以较小的种植体应力增幅获得较大的界面应力差减幅。需要强调的是,这种非线性特点仅限于基台和种植体相连的一段式种植体。由上述讨论可知,与种植体模量相同的基台相比,更高模量的基台会使种植体及周围骨的应力更高。然而,结合种植体弹性模量对其本身承载能力的影响特性,种植体应在满足其对咀嚼负载需求的前提下适当降低其弹性模量以实现更好生物力学性能,这与吕越等[53]观点一致。而2#和3#种植体能够满足这一要求,并且对于皮质骨具有良好的使用安全性。此外,若要改善皮质骨上端应力随弹性模量降低而增加的现象,在植入骨组织时适当增加植入深度是一种方法。
倾斜条件下,弹性模量为30GPa的4#种植体在松质骨植入位置底部的应力集中消失,与Korabi等[44]观察到剪切应变明显减弱的植入物模量(23GPa)相似。当横向载荷分量存在时,弹性模量降低,种植体的变形向颈部集中、底部的变形减小,所以Zr24Nb在松质骨的应力耗散集中于植入位置的上部。然而,钛种植体则相反,且在松质骨底部存在较为明显的应力集中。Primoradian等[54]利用弹性模量与松质骨相近的有机玻璃并通过光弹性试验获得了倾斜加载时钢植入物(190~210MPa)在有机玻璃中的应力分布,结果显示应力集中在植入位置上部的一侧和底部,并且钛植入物的有限元结果显示长度为10mm的种植体(不同螺距)在松质骨内产生的最大应力为7~8MPa,实验与模拟研究均与本研究结果较为一致。
Zhang等[55]对种植体骨内段的中间部分应用了低刚度的多孔结构,进而获得了相比固体钛种植体更均匀的应力分布以及更小的应力。这种方法实际上是在较高和较低模量种植体对松质骨产生的2种应力响应间取得平衡。
相似地,2#、3#种植体的刚度介于1#和4#种植体,因此在松质骨中产生的应力分布情况则介于两者之间,植入位置界面的上部和下部没有明显的应力差距,在植入位置的周围均有应力分布,螺纹间的应力分布区域大小相近,没有出现前两者螺纹间应力分布区域逐渐减小的现象,整体的应力分布更为均匀。2#、3#种植体产生均匀的应力耗散对于松质骨是有利的。此外,倾斜载荷下应力分布更均匀的2#种植体在松质骨顶端应力集中处产生的Mises应力最小。
5、结论
1)对于一段式种植体,弹性模量较低的种植体在倾斜载荷下的承载能力明显减弱,在骨组织中产生的应力更大。但Zr30Ti和Zr22Nb种植体及骨组织中的最大应力仍小于其强度,承载较大的皮质骨也具有良好的应用安全性。
2)随着弹性模量的降低,一段式种植体颈部内部的应变区扩大,变形协调性增加,两者共同促进了种植体向皮质骨的应力传递,减小了种植体-骨组织的界面应力差。
3)种植体弹性模量的降低促使松质骨中的应力向上部集中,中等弹性模量的材料(Zr30Ti和Zr22Nb)在松质骨中产生的应力分布更均匀。
参考文献 References
[1] Niinomi M, Nakai M, Hieda J. Acta Biomaterialia[J], 2012, 8(11): 3888
[2] Sato E, Shigemitsu R, Mito T et al. Computers in Biology and Medicine[J], 2021, 129: 104173
[3] Geetha M, Singh A K, Asokamani R et al. Prog Mater Sci[J],2009, 54: 397
[4] Wang Shengnan(王胜难), Cui Yue(崔 跃), Yuan Zhishan(袁志山) et al. Rare Metal Materials and Engineering(稀有金属材料与工程)[J], 2015, 44(2): 509
[5] Sun Chunchun(孙纯纯), Guo Zhijun(郭志君), Zhang Jinyong(张金勇) et al. Rare Metal Materials and Engineering(稀有金属材料与工程)[J], 2022, 51(3): 1111
[6] Mehjabeen A, Song T, Xu W et al. Advanced Engineering Materials[J], 2018, 20(9): 1800207
[7] Luo Cong(罗 聪). Research on Preparation, Microstructure and Mechanical Properties of New Biomedical Zirconium Alloy[D]. Nanjing: Southeast University, 2024
[8] Liu Yangyang(刘杨杨). Investigation on Mechanical Properties and Bio-corrosion Resistance of Zr-2.5Nb Alloy Processed by Laser Shock Peening(激光冲击Zr2.5Nb合金的力学性能及生物耐腐蚀性能的研究)[D]. Shenyang: Northeastern University, 2021[9] Jiang J, Zhou C, Zhao Y W et al. Journal of the Mechanical Behavior of Biomedical Materials[J], 2020, 112: 104048
[10] Hsu H C, Wu S C, Sung Y C et al. Journal of Alloys & Compounds[J], 2009, 488(1): 279
[11] Zhou Yunkai, Jing Ran, Ma Mingzhen et al. Chinese Physics Letters[J], 2013, 30(11): 3
[12] Kondo R, N mura N, Suyalatu et al. Acta Biomaterialia[J], 2011, 7(12): 4278
[13] Calì M, Zanetti E M, Oliveri S M et al. Dental Materials[J], 2018, 34(3): 460
[14] Jiang X Y, Yao Y T, Tang W M et al. Journal of Biomedical Materials Research Part A[J], 2020, 108(8): 1634
[15] Matsuzaki M, Ayukawa Y, Sakai N et al. Computer Methods in Biomechanics & Biomedical Engineering[J], 2018, 20(4): 393
[16] Bataineh K, Al Janaideh M. Clin Implant Dent Relat Res[J], 2019, 21(6): 1206
[17] Jiang Songji(江崧骥), Wu Yin(吴 音), Si Wenjie(司文捷). Rare Metal Materials and Engineering(稀有金属材料与工程)[J], 2015, 44(S1): 387
[18] Fabris D, Moura J P A, Fredel M C et al. Journal of Biomedical Materials Research Part B: Applied Biomaterials[J], 2022, 110(1): 79
[19] Lopez C A V, Vasco M A A, Ruales E et al. Journal of Oral Implantology[J], 2018, 44(6): 409
[20] Vadiraj B, Rao P K, Kiran K K. Materials Today: Proceedings[J], 2023, 76: 564
[21] Li Hongbo(李鸿波), Yao Yueling(姚月玲). Chinese Journal of Prosthodontics(口腔颌面修复学杂志)[J], 2007, 8(3): 164
[22] Piotrowski B, Baptista A A, Patoor E et al. Materials Science and Engineering C[J], 2014, 38: 151
[23] Wang Rong(王 蓉). Mechanical Behavior of Dental Implant in Mandible and New Load-transfer Method by 3D FEA(下颌牙种植体力学行为及 3D FEA 新型载荷传递方式的有限元分 析)[D]. Chengdu: Sichuan University, 2005
[24] Huang Jia(黄 佳), Zheng Yang(郑 旸), Song Xiaomeng(宋晓萌) et al. Stomatology(口腔医学)[J], 2020, 40(5): 5
[25] Eijden T M V. Critical Reviews in Oral Biology & Medicine[J], 2000, 11(1): 123
[26] Lin D, Li Q, Li W et al. J Mech Behav Biomed Mater[J], 2009, 2(5): 410
[28] Ding X, Liao S H, Zhu X H et al. Materials & Design[J], 2015, 84(5): 144
[29] Huang H L, Hsu J T, Fuh L J et al. Computers in Biology & Medicine[J], 2010, 40(5): 525
[30] Zhang Chengxun(张成勋). Study on Efficient Meshless Method for Mechanical Analysis of Orthotropic Materials(正交各向异性材 料 力 学 分 析 的 高 效 无 网 格 法 研 究) [D]. Dalian: Dalian University of Technology, 2023
[31] Dhatrak P, Girme V, Shirsat U et al. Bio Nanoscience[J], 2019, 9: 652
[33] Ziaie B, Khalili S M R. Prosthesis[J], 2021, 3(4): 300
[34] Zhang Jianguo(张建国), Chen Chen(陈 晨), Hu Fengling(胡凤玲) et al. Chinese Journal of Tissue Engineering Research(中国组织工程研究)[J], 2022, 26(4): 585
[35] Gao Wenbo(高文波), Ma Zongmin(马宗民), Li Shuxian(李淑娴) et al. Chinese Journal of Tissue Engineering Research(中国组织工程研究)[J], 2022, 26(6): 875
[36] Prados-Privado M, Martínez-Martínez C, Gehrke S A et al. Biology[J], 2020, 9(8): 224
[37] Tretto P H W, Santos M B F D, Spazzin A O et al. Computer Methods in Biomechanics and Biomedical Engineering[J], 2020, 23(8): 372
[38] Menacho-Mendoza E, Cedamanos-Cuenca R, Díaz-Suyo A. The Saudi Dental Journal[J], 2022, 34(7): 579[39] Avağ C, Akkocaoğlu M. Journal of Stomatology, Oral and Maxillofacial Surgery[J], 2023, 124(1): 101298
[40] Qin S Q, Gao Z. Computer Methods in Biomechanics and Biomedical Engineering[J], 2023, 26(12): 1499
[41] Kumar S C, Kapoor R, Khan D. Materials Today: Proceedings[J], 2022, 56: 1143
[42] Wang K, Geng J, Jones D et al. Mater Sci Eng C Mater Biol Appl[J], 2016, 63: 164
[43] Shemtov-Yona K, Rittel D. Journal of the Mechanical Behavior of Biomedical Materials[J], 2016, 62: 1
[44] Korabi R, Shemtov-Yona K, Rittel D. Clinical Implant Dentistry & Related Research[J], 2017, 5(19): 935
[45] Yu Yang( 俞 洋). Study on Connection Stability and Fatigue Performance of Dental Implants(牙种植体连接稳定性及疲劳性能研究)[D]. Shenyang: Northeastern University, 2018
[46] Jiang Yang( 姜 杨). Study of the Mechanical Properties of Denture and the Method of Evaluating Its Life Span(义齿力学特性及其寿命的评估方法研究)[D]. Wuxi: Jiangnan University, 2021
[47] Frost H M. Angle Orthod[J], 2004, 74(1): 3
[48] Jakub K, Barbara L, Joseph N et al. Coatings[J], 2021, 11(7): 865
[49] Tomas A, Pentti T, Luis A P et al. Clinical Implant Dentistry and Related Research[J], 2022, 24(4): 532
[50] Jimbo R, Halldin A, Janda M et al. Int J Oral MaxillofacImplants[J], 2013, 28(4): e171
[51] Kitamura E, Stegaroiu R, Nomura S et al. Journal of Oral Rehabilitation[J], 2005, 32(4): 279
[52] Alemayehu D B, Jeng Y R. Materials[J], 2021, 14(22): 6974
[53] Lv Yue( 吕 越), Xu Kan( 徐 侃), Wang Liqiang( 王 立 强) et al. Journal of Medical Biomechanics(医用生物力学)[J], 2017, 32(4): 5
[54] Pirmoradian M, Naeeni H A, Firouzbakht M et al. Comput Methods Programs Biomed[J], 2020, 187: 105258
[55] Zhang J Y, Zhang X, Chen Y et al. Materials[J], 2021, 14(22): 6918
(注,原文标题:新型医用锆合金静力加载有限元研究)
tag标签:生物力学,牙科种植体,材料选择,有限元分析,Zr30Ti,Zr22Nb,承载能力,骨重塑



