发布日期:2025-8-10 9:02:40
引言
人体内常发生骨相关的退化或恶化现象,如股骨头坏死、关节损伤、牙齿的磨损和腐蚀等,不仅使患者遭受疼痛,而且组织和器官可能出现部分或完全的功能性丧失 [1]。尤其是随着人口老龄化程度的加深,相关疾病所累及的人口持续增加,对生物医用材料的需求不断提高,生物医用金属材料、陶瓷材料、高分子材料等得到广泛的关注与应用。其中金属及合金由于具有高强度、高韧性和优良的抗疲劳性能,广泛应用于人体硬组织、软组织、人工器官和外科辅助器材等各个方面,是医用植入物和设备必不可少的材料。图 1 是由金属及合金材料通过复杂的加工工艺制造出的各类植入物产品,如心血管支架、接骨板、接骨螺钉、人工关节、牙种植体、脊柱内固定植入物等,其在临床上的应用量在 40% 以上,是临床应用最广泛的承力型植入材料 [2]。
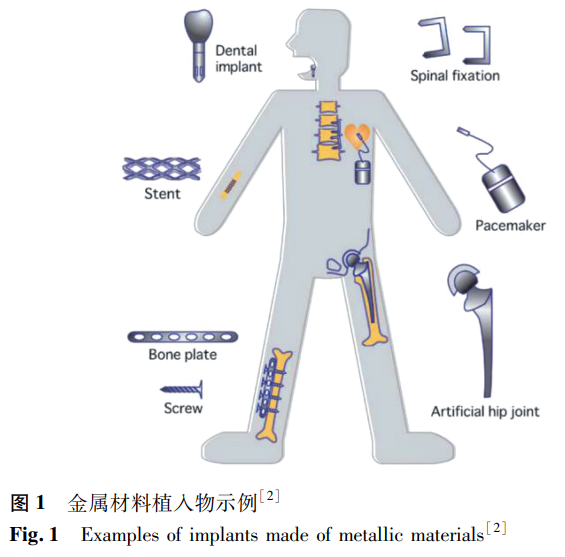
骨科植入物常用金属材料主要有医用不锈钢、钴基合金、钛及其合金三大类。较早实现临床应用的医用不锈钢(316L)和钴基合金(如 Co-Cr-Mo 合金)由于含有 Ni、Co、Cr 等元素,存在致敏、致畸、致癌等潜在危害 [3],还存在耐腐蚀性能差、弹性模量高、无生物活性等问题,在临床上逐渐被 Ti 合金取代。钛及钛合金密度小,比强度高,弹性模量较低,生物相容性和耐腐蚀性能都优于不锈钢和钴基合金。自 20 世纪 40 年代被引入到生物医学领域以来,Ti 及其合金得到快速发展并实现商业化,商业纯钛(cp-Ti)和 Ti-6Al-4V(质量分数,%,如无特别说明,下同)是典型代表 [4]。但有研究发现,cp-Ti 的强度较低,使得小直径螺钉(≤3.5mm)断裂的概率大大增加,限制了其在高应力作用下的应用 [5]。而且 Ti 合金硬度较低,耐磨性差,磨损的颗粒腐蚀产物会进入生物组织,引起植入物失效。大量的临床实验与数据证明,Ti-6Al-4V 合金中的 Al 和 V 都会导致长期的健康问题,在人体组织中引起不良反应 [6-7]。此外,cp-Ti 和 Ti-6Al-4V 的弹性模量分别约为 105GPa 和 110GPa,尽管相对于 316L 不锈钢(210GPa)和 Co-Cr-Mo 合金(240GPa)有大幅度降低,但是仍然显著高于人体皮质骨的弹性模量(10-30GPa),这会造成金属植入物和周围骨骼之间的应力遮挡效应 [8-9],从而导致骨吸收或骨萎缩,引起植入物松动或断裂,对人体造成二次伤害。随着中、青年创伤的增加,人们对植入物材料的性能和使用年限有了更高的要求,钛及钛合金的问题愈加突出,也推动着研究人员开发性能更优异的新型 Ti 基合金或其他新型生物医用金属材料,以取代 Ti-6Al-4V 合金。
锆(Zr)是一种无毒金属,具有良好的耐腐蚀性能、生物相容性和力学性能。因为 Zr 和 Ti 在元素周期表中属于同一主族,具有相似的物理和化学性质,所以常被用作合金化元素添加至 Ti 合金中以提高力学性能。据报道,在元素周期表中的金属,只有 Zr 和 Ti 支持成骨细胞生长和骨整合。与 Ti 及其合金相比,Zr 合金具有高强度、高断裂韧性和低弹性模量;具有更低的磁化率 [11],能显著降低伪影,几乎不会对磁共振成像(MRI)造成干扰;Zr 还具有比 Ti 更高的骨接触程度,具有低离子释放、低细胞毒性和良好的骨整合能力 [12]。目前,Zr 及其合金作为创伤科、骨科和牙科植入物材料在医学领域受到青睐,尤其是表面氧化的 Zr-2.5Nb 合金(Oxinium)因优异的耐磨性已被成功商用于人工膝关节和髋关节 [13]。此外,Zr 在暴露于空气或水溶液中时容易自发形成致密的氧化膜(ZrO₂),这层氧化膜不仅能够降低腐蚀速率,抑制金属离子释放,而且决定了其生物相容性和骨整合程度。Zr 合金表面这种氧化层的生物惰性和不可吸收特性使 Zr 及其合金成为骨科植入物的理想候选材料。为了赋予合金以生物活性,人们也陆续开发了几种新的表面改性技术修饰 Zr 合金表面,如微弧氧化、等离子喷涂、碱性处理、溶胶 - 凝胶法等,以提高合金的骨整合能力。表面改性技术的应用促进了 Zr 合金植入物与骨骼的良好融合,是将生物医用 Zr 合金推向临床应用的重要环节。
Zr 基合金是最有前途的现代生物医用材料之一,具有取代 Ti 及其合金成为新一代生物医用金属材料的巨大潜力。基于 Zr 基合金的优良性能与发展前景,本文将归纳目前医用 Zr 合金研究的主要合金体系,对合金的基本性能与表面改性技术进行总结,并对医用 Zr 合金的未来发展方向进行展望,为后续骨科植入物材料的发展提供有价值的参考。
1、医用锆合金体系
Zr 有两种晶格结构,室温下为密排六方(hcp)结构,称为 α-Zr,α-Zr 在约 863℃时发生同素异构转变,转变为体心立方(bcc)结构,称为 β-Zr。Zr 合金在生物医学领域的研究可追溯至 20 世纪 90 年代,Zr 因其耐腐蚀性能优良且是无毒金属,常被用作 Ti 的合金化元素。研究表明,Ti-Zr 合金硬度和拉伸强度均随 Zr 含量的增加而提高,且比纯 Ti 和 Ti-6Al-4V 合金具有更高的硬度、拉伸强度和更接近人骨的弹性模量 [16],在生物环境中具有良好的耐腐蚀性和稳定性 [17],作为牙科种植体材料在临床中具有高种植成功率(95.2%~100%)[18-21],表现出良好的骨融合与可接受的骨水平变化。Ti-Zr 合金的成功种植促进了医用 Zr 合金的研发,通过添加一些无毒的金属元素,如 Nb、Mo、Sn、Ti、Cu、Si、Ta 等,得到性能优异的 Zr 合金。Guglielmoti 等 [22] 使用酸洗后的纯 Zr 与纯 Ti 植入物植入维斯塔尔(Wistar)大鼠体内并保持 30d,结果表明 Zr 与大鼠胫骨能发生更良好的界面反应,说明 Zr 具有更良好的骨相容性,其腐蚀产物的毒副作用也更低。Tsutsumi 等 [23] 研究发现,Zr 不会与钙发生反应形成磷酸钙(人骨的主要成分),而是形成高度稳定且具有保护作用的磷酸锆,Zr 的这种特性可以避免与骨骼同化,进而避免骨折发生。
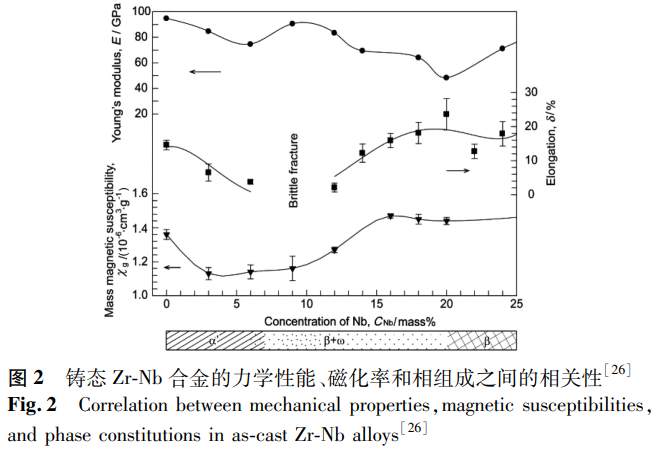
通过调节添加元素的种类和含量可以提高 Zr 合金的力学性能、耐腐蚀性能等。从目前对医用 Zr 合金的研究与探索来看,医用 Zr 合金主要可分为三大系列:Zr-Nb 系、Zr-Mo 系及 Zr-Ti 系合金。Nb 是 Zr 合金的有效强化元素,也是 β-Zr 稳定元素。2009 年,Branzi 等 [24] 研究了 Zr-xNb(x=0,2.5,10)合金的电化学行为和表面硬度,发现其耐腐蚀性能和表面硬度均随 Nb 含量增加而提高,从而使该合金在人体关节置换术中的应用成为可能。同时期,Nomura 等 [25] 研究了 Zr-xNb(x=0~40)合金相组成对其磁化率的影响,发现随着 Nb 含量的增加,相组成会发生 α'→α'+β+ω→β+ω→β 的转变,ω 相的存在会显著降低合金的磁化率,铸态 Zr-3Nb 合金的磁化率几乎是 Ti-6Al-4V 合金的 1/3。在此基础上,Kondo 等 [26] 进一步研究了铸态 Zr-Nb 合金中相组成对其力学性能与磁化率的影响,结果如图 2 所示。研究表明,由 α 或 β 相组成的 Zr-Nb 合金具有优异的力学性能和较低的磁化率,可用于磁共振成像下的医疗设备,而 ω 相的存在虽然使磁化率降低,但也使合金变得易碎,延展性和韧性降低。因此,当需要低磁化率和高杨氏模量时(例如动脉瘤夹),由 α 相组成的 Zr-Nb 合金较为适用;当需要低磁化率、低杨氏模量和大伸长率时(例如髋关节假体、骨板和螺钉),主要由 β 相和少量 ω 相组成的 Zr-Nb 合金较为适用。为了评估 Zr-Nb 合金的生物医学应用,Zhou 等 [27] 对退火态 Zr-xNb(x=0,2.5,16,22)合金的显微组织、腐蚀行为和细胞毒性进行了研究,发现随着 Nb 含量的增加,合金的耐腐蚀性能提高,Zr-22Nb 合金具有最佳的电化学性能和良好的生物相容性。基于 ω 相的低磁化率特性,Kondo 等 [28] 通过冷轧 Zr-14Nb 证实了 ω 相可由应变诱导形成,且 ω 相的形成降低了 Zr-14Nb 的磁化率,其磁化率约为 Ti 合金的 1/3。Zhao 等 [29] 也通过形变诱导 ω 相变和冷轧,得到了具有低磁化率、杨氏模量可调的 Zr-17Nb 合金,其可以作为脊柱固定杆的潜在应用材料。
在 Zr-Nb 二元合金体系的基础上,研究人员通过添加合金元素 Ti、Ta、Mo、Sn 等开发了三元医用 Zr 合金。Nie 等 [30] 制备了铸态 Zr-20Nb-xTi(x=0,3,7,11,15,原子分数,%)合金,该合金力学性能较 Zr-Nb 二元体系有所改善,拥有更高的弹性能,这意味着添加 Ti 可以使合金承受更大的弹性变形。Xue 等 [31] 研究了由 α'+β 相组成的铸态 Zr-16Nb-xTi(x=0,4,8,12,16)合金,结果表明 Zr-16Nb-4Ti 合金具有良好的生物相容性和耐腐蚀性能,实现了低弹性模量(50GPa)和低磁化率的性能组合。王明康等 [32] 研究了 Ti 对 Zr-Nb 系二元合金 β 结构稳定性和力学性能的影响,发现添加适量的 Ti 会显著抑制 ω 相的析出,提高 β 结构的稳定性,但过量 Ti 替代 Nb 时会降低 β 相的稳定性。综合来看,Zr-Nb-Ti 合金作为一种骨科植入物材料具有较高的研究价值与应用潜力。Rosalbino 等 [33] 研究了 Zr-Nb-Ta 三元合金的体外耐腐蚀性能和生物相容性,认为该三元合金作为外科植入物具有良好的应用前景。Liang 等 [34] 采用基于 CALPHAD 的建模方法对 Zr-Nb-Mo 三元合金的成分进行筛选,同时对合金整体及其〈100〉方向的杨氏模量进行预测,结果显示〈100〉方向的杨氏模量更小,该研究利用计算方法开辟了一种开发生物医用材料的新途径。
Mo 具有低磁化率(χ_Ho=0.75×10⁻⁶cm³/g)、低细胞毒性,是 Zr 的有效强化元素。Suyalatu 等 [35] 对铸态 Zr-Mo 合金的磁化率和力学性能与微观结构之间的关系进行研究,结果显示 Zr-1Mo 合金以针状的 α 相为主,Zr-3Mo 合金以 β 相和 ω 相为主,Mo 含量超过 10% 的合金中只有 β 相存在;铸态 Zr-Mo 合金的磁化率随 Mo 含量的增加呈先降低后升高的趋势,Zr-3Mo 合金由于 ω 相的存在,磁化率最低,但也发生了脆性断裂,在经过时效处理后 Zr-3Mo 合金的相组成转变为 α+β 相,强度和延伸率显著提高 [36]。Zhou 等 [37] 研究发现 Zr-xMo(x=0,1,3,5,10)合金均具有优异的耐腐蚀性能和生物相容性,表面由 Zr 和 Mo 氧化物形成的混合钝化膜比单一的 ZrO₂钝化膜更稳定;以 α 相为主的 Zr-1Mo 合金表现出更高的硬度、弯曲强度和模量,意味着更高的塑性变形与耐磨性,由 β 相组成的 Zr-10Mo 合金虽然强度略低,但具有更接近人骨的弹性模量。Nie 等 [38] 将 Ti 元素引入 Zr-Mo 合金中,制备了铸态 Zr-12Mo-xTi(x=0,3,7,11)合金,所有合金均为 β 相,随着 Ti 含量增加,合金的晶粒变小,组织细化,具有优异的屈服强度(1175-1375MPa)和合适的杨氏模量(32-35GPa),弹性能(20-28MJ/m³)显著高于大多数 Ti 基合金(1-5MJ/m³),具有很好的生物应用潜力。Guo 等 [39] 设计并制备了一种低成本的新型亚稳态 β 型 Zr-4Mo-4Sn 合金,采用原位 XRD 技术和 Eshelby-Kroner-Kneer 弹塑性自治模型,从 β 型 Zr-4Mo-4Sn 多晶中提取了单晶弹性常数(C₁₁,C₁₂,C₄₄),发现合金在 {110}<110 > 和 {001}<100 > 取向的剪切下具有较低的 β 相稳定性,这导致了 Zr-4Mo-4Sn 合金的低杨氏模量,为设计和开发具有超低杨氏模量和低磁化率的新型 β 型 Zr 合金提供了一些新思路。
Zr-Ti 合金因具有熔点低、磁化率低、线膨胀系数低等优点,在牙科等硬组织替代物材料中受到青睐。2009 年,Hsu 等 [40] 对 Zr-xTi(x=0~40)合金的晶体结构和力学性能进行研究,发现添加 10% Ti 可以使 Zr 合金抗弯强度与弹性模量的比值提高 70%。Wei 等 [41] 制备了牙科植入用的新型 Zr-25Ti-xMo(x=0~12.5)合金,发现随着 Mo 含量的增加,合金的相组成发生 α 相→α+β 相→β 相的转变,杨氏模量为 17.7-24.4GPa,与人骨相适配,其中 Zr-25Ti-7.5Mo 合金表现出最佳的耐磨与耐腐蚀性能,是极具潜力的牙科植入物材料。Wang 等 [42] 研究了 Nb 元素对 Zr-Ti 基生物材料力学性能和耐腐蚀性能的影响,发现合金均由 β 相和 α'' 相组成,Nb 元素的添加提高了合金中 β 相的稳定性,应力诱发马氏体相变极大地提高了材料的抗拉强度和塑性,且材料在生理盐水中表现出较强的耐腐蚀性能。
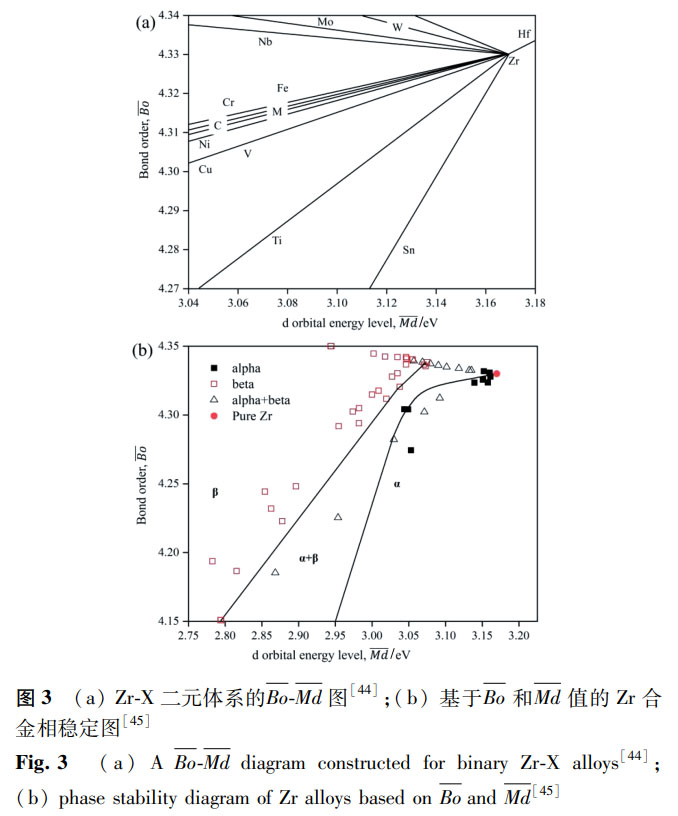
除 Zr-Nb、Zr-Mo 和 Zr-Ti 系合金外,其他合金(如 Zr-Hf、Zr-Cu、Zr-Sn 等)也有研究,但整体而言,生物医用 Zr 合金的研究还是较少,新型的合金成分设计、多组元化是研究的重要方向。在合金设计上,Mo 当量公式、d 电子理论、价电子浓度等理论常用于指导 Ti 合金的成分设计,同样也可以用于设计 Zr 基金属植入物,但这些理论的完善仍需要大量实验数据的支撑。其中,d 电子理论采用 Bo(金属元素间的结合次数)和 Md(合金元素的 d 轨道能)两个参数来控制合金的相稳定性和性能,且经实验验证取得了理想的性能预测与成分优化效果,被证明是设计新型医用 Ti 合金的有效方法 [43]。针对 Zr 合金,Shibutami [44] 绘制了 Zr-X 二元体系合金的 Bo-Md 图,以了解各元素合金化对 Bo 和 Md 值的影响,如图 3a 所示;在此基础上,Afrin 等 [45] 计算了一系列 Zr 合金的 Bo-Md 值,分析了 Zr 合金相变、性能和 Bo-Md 的关系,如图 3b 所示。对于成分已知的 Zr 合金,计算合金的 Bo 和 Md 值,在图上找到相应的位置,可以初步预测所设计合金的性能是否满足生物医用材料的要求。Bo-Md 图可以协助低模量 Zr 基合金的设计,但仍需要更多的实验结果与计算来确定详细的相稳定临界条件,为合金设计提供准确的理论依据。
2、医用锆合金的性能要求与研究现状
2.1 力学性能
医用金属材料通常作为受力器件在人体内 “服役”,应用为人工关节、骨板骨钉、牙种植体、人工椎体等,因此其力学性能是需要重点关注的对象之一。人体部分骨骼的受力状态是相当恶劣的,如人工髋关节在行走过程中(下肢偏转)作用在髋关节上的力是体重的数倍 [46],若要使其使用寿命保持在 15 年以上,则材料必须具有优良的力学性能和耐磨性。人骨的强度并不是很高,如股骨头的抗压强度仅为 143MPa,纵向弹性模量约为 13.8GPa,径向弹性模量为纵向的 1/3,但其断裂韧性较高。为防止材料在冲击载荷下发生断裂,通常要求材料的强度高于人骨的 3 倍。目前商用的金属植入物的弹性模量均远高于人骨,这会诱发应力遮挡效应 [47],引起人体骨吸收并导致种植体松动,因此植入物金属材料的弹性模量应当与人骨接近。在长期临床经验基础上,人工髋关节的医用金属材料应满足的基本力学性能要求 [48]:屈服强度不低于 450MPa,极限抗拉强度不低于 800MPa,疲劳极限高于 400MPa,弹性模量不超过人骨(10-30GPa),伸长率高于 8%。因此,在进行生物医用金属材料的成分与结构设计过程中,需要充分考虑人体骨骼的性能,设计出与其相匹配的材料。
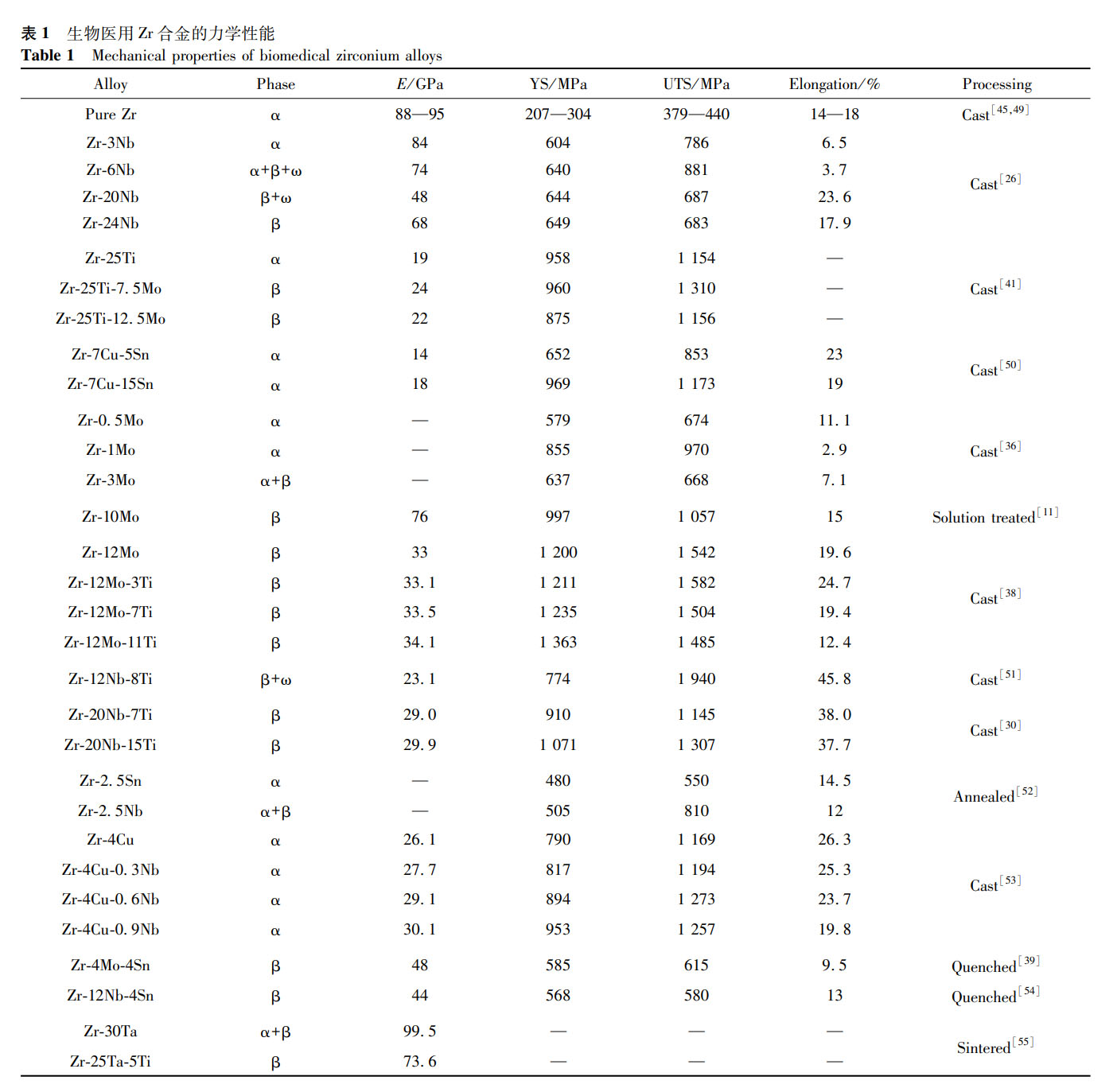
Zr 基合金的力学性能在很大程度上取决于其化学成分和相结构 [26]。Zhou 等 [14] 系统研究了含不同合金元素的 Zr-1X 合金的显微组织、力学性能和磁化率,如图 4 所示。
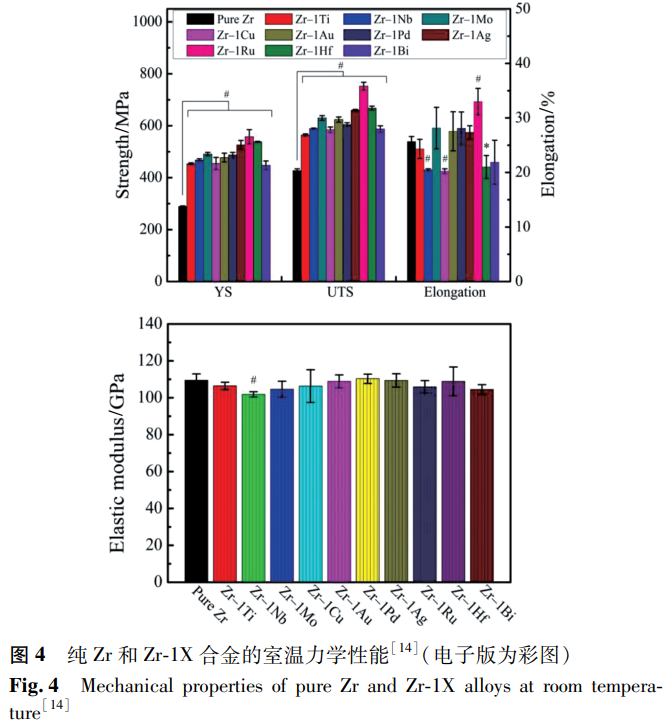
合金均由 α 相组成,合金化显著提高了纯 Zr 的强度和硬度,这些具有高杨氏模量和低磁化率的 α 相 Zr 合金是 MRI 环境下医疗器械的良好候选合金。表 1 总结了目前研究的一些医用 Zr 合金材料的力学性能数据。由表 1 可知,铸态纯 Zr 的强度较低,屈服强度(YS)为 207-304MPa,极限抗拉强度(UTS)为 379-440MPa,杨氏模量为 88-95GPa,这与 Zr 中杂质的含量不同有关。添加 Nb 可明显提高 Zr 的强度,其强化作用与 Nb 含量和相组成密切相关。有研究发现 β 型 Zr-Nb 合金具有良好的力学性能,Zr-(3-24)Nb 合金的 YS 在 559-750MPa,UTS 在 605-881MPa,弹性模量最低降至 48.4GPa。Ti 和 Mo 的添加也可以提高合金的强度,铸态 Zr-20Nb 合金的 YS 为 857MPa,UTS 为 1046MPa,添加 15% Ti 后,YS 和 UTS 分别增加到 1071MPa 和 1307MPa [30],在纯 Zr 中加入 1% Mo 可得到 970MPa 的 UTS [36],但其断裂韧性较差。总体来看,由 β 相组成的 Zr 合金更适用于需要高强度、低弹性模量和较大延伸率的情况,也是目前医用 Zr 合金研究的主要方向。
2.2 耐腐蚀性能
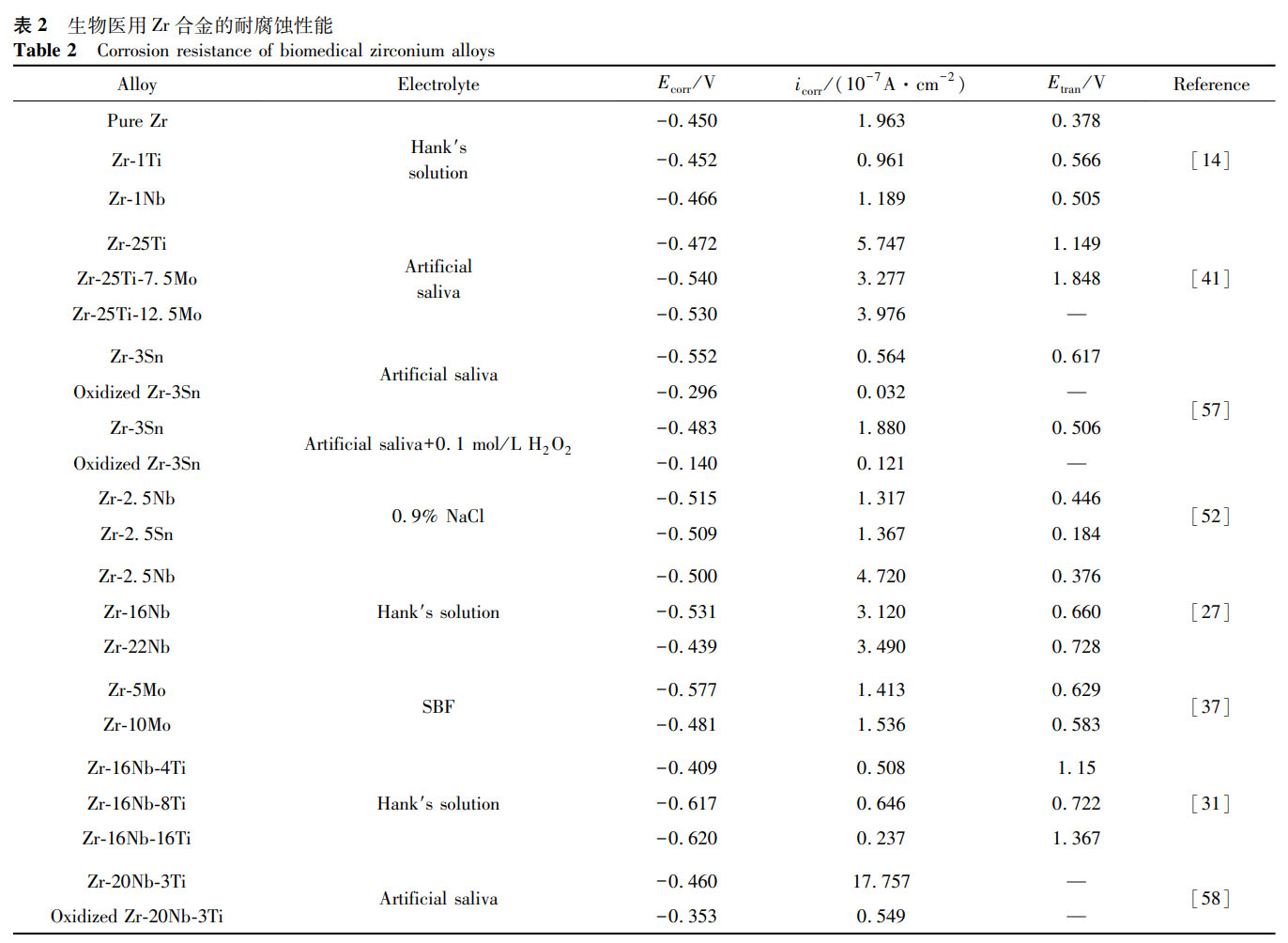
人体是一个严苛的腐蚀环境,体液中存在 Na⁺、Cl⁻和 HCO₃⁻等以及各种复杂的有机化合物,如蛋白质、酶、糖类等,金属材料植入体内后需持久地浸泡于其中,被化学侵蚀在所难免 [3]。而且人体内不同部位的 pH 值也不尽相同,体内组织在受伤或感染时 pH 值也会发生变化。例如正常情况下体液的 pH 值为 7.4,受伤时可能低至 3.5,感染时有可能升高至 9.0 [56],这使得金属植入物在体内不同 pH 条件下显示出不同的耐腐蚀性。腐蚀不仅破坏金属材料的力学性能,导致其断裂,还可能产生对人体有刺激性和毒性的腐蚀产物,因此优异的耐腐蚀性能对金属植入物来说至关重要。医用金属材料在生理环境中的腐蚀机制十分复杂,材料与人体之间相互影响、互为因果,而且腐蚀有时会同时出现几种类型,这对医用金属材料的腐蚀实验研究和测试技术也提出了更高的要求。
纯 Zr 在各种水溶液和酸中具有优异的耐腐蚀性能,由于对氧的高亲和力,Zr 基合金表面会自发形成氧化层,这进一步提高了它们的耐腐蚀性能。表 2 总结了目前研究的一些医用 Zr 合金材料的耐腐蚀性能数据。从表 2 可以看出:(1)通过合金化整体降低了腐蚀电流密度,提高了纯 Zr 的耐腐蚀性能,其中元素 Ti、Nb、Ta 对增强 Zr 抗点蚀能力的效果显著;(2)电解质对 Zr 及其合金表面氧化膜的生长和稳定性有较大影响,它们的耐腐蚀性能随着 Cl⁻的存在而恶化,即随着 Cl⁻向氧化膜内的迁移,钝化膜容易受到侵蚀,形成点蚀;(3)在多种实验环境中 Nb 元素的添加都改善了 Zr 合金的耐腐蚀性能,这归功于表面生成了更加致密且稳定的铌氧化物;(4)目前的研究中,氧化处理后的 Zr-3Sn、Zr-20Nb-3Ti 等合金腐蚀电流密度均明显低于未氧化 Zr 合金,同等实验条件下未发生击穿现象,说明预氧化 Zr 合金具有较为优异的耐腐蚀性能。
2.3 生物相容性
良好的生物相容性是骨科植入物材料的基本要求,理想的骨科植入物应该在预期的使用周期内既不会引起宿主机体明显的临床反应,也具有良好的物理和化学稳定性。良好的生物相容性具体表现在:对人体无毒、无刺激、无致癌、无突变等有害作用;对人体无排异反应;与周围的骨骼及组织能够形成化学键合,具有生物活性;无溶血、凝血反应 [59]。
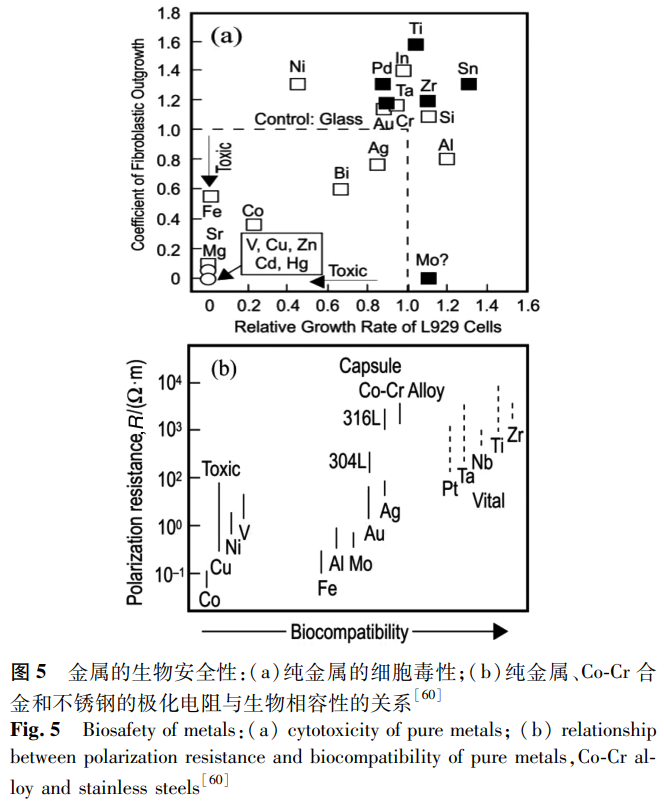
纯金属的细胞毒性以及纯金属、Co-Cr 合金和不锈钢的极化电阻与生物相容性的关系 [60] 如图 5 所示,可见 Zr、Nb、Ti 和 Ta 都具有良好的生物相容性。Fe 和 Mn 极易腐蚀并引起细胞毒性和基因毒性反应,人体血液中 Fe 含量升高会导致细胞损伤 [61]。Cr 具有优异的耐腐蚀性能和较低的细胞毒性,但具有强氧化性的 Cr⁶⁺会引起过敏反应,损伤人体的肝脏和肾脏,并具有致癌和遗传毒性 [62]。Co 也被证明具有致癌和细胞毒性作用,会引起周围组织的过敏反应和超敏反应。Ti 通常被认为是最具生物相容性的金属之一 [63],纯 Ti 具有良好的生物相容性和低的细胞毒性,这都归功于表面 TiO₂层的形成。然而,Ti 基合金中最常见的合金元素 V 和 Al 会破坏 cp-Ti 优越的生物性能,V 被证明具有致癌作用,而 Al 虽然被证实并不是阿尔兹海默症的原因 [64],但体内 Al 含量的增加会促进骨骼的脱矿,对肾脏有害,容易引发女性乳腺癌 [65]。Zr 和 Nb 都具有极强的生物相容性,细胞毒性低,无致癌性和突变性,耐腐蚀性好,其骨相容性甚至优于 Ti。Zhou 等 [27] 将纯 Zr 和 Zr-Nb 合金置于 L-929 细胞培养基中培养 96h 后,细胞活力始终保持在 95% 以上,该合金对细胞生长和增殖几乎无影响,具有优异的体外细胞相容性。通常认为,Ti、B、Mg、Si、P、Ca、Sr、Zr、Nb、Mo、Pd、In、Sn、Ta、Pt、Au 是生物相容性元素,Be、Al、V、Cr、Mn、Fe、Co、Ni、Cu、Zn、Ag 是有害元素 [65]。因此,在对合金设计时应选用 Nb、Ta、Ti、Mo、Sn 等无毒元素,设计出弹性模量更低、强度和耐腐蚀性更高的新型 β 型 Zr 基合金。
2.4 其他性能
对骨科植入物金属材料来说,除上述性能外,根据植入物的不同使用功能还需要满足一些特殊的性能要求,如抗菌性、可消毒性能与磁性能等。有数据显示,即使经过了严格的无菌操作,种植修复术后口腔种植体周围炎的患病率也可达 22%,远高于骨折内固定术(0.4%-16%)和全关节置换术(膝盖 0.5%-2%,髋 2%-9%,脚踝 0.3%-1.7%)后种植体周围炎的患病率 [66]。近期发展的抗菌医用金属材料(Ti-Cu [67]、Ti-Zr-Cu [68]、Ti-Nb-Ag [69])主要是通过添加适量具有强抗菌功能的 Cu、Ag 等元素,在生理环境中持续、微量地释放抗菌离子,起到广谱、持久的抗菌作用。通过表面涂层技术将微量的 Ag、Cu、Zn 等重金属掺入其中,从抗菌涂层中浸出的 Cu²⁺、Ag⁺或 Zn²⁺会破坏细菌的细胞壁和细胞膜,也是提高合金抗菌性能的常用途径 [70]。植入物还应当具备可灭菌性能。通常在术前需要对植入物进行严格灭菌,从而避免其上携带的细菌等导致植入物周围组织感染。常见的用于医疗器械的灭菌方法有热灭菌法、化学灭菌法和辐射灭菌法三种,不过金属材料一般都具备良好的可灭菌性能。
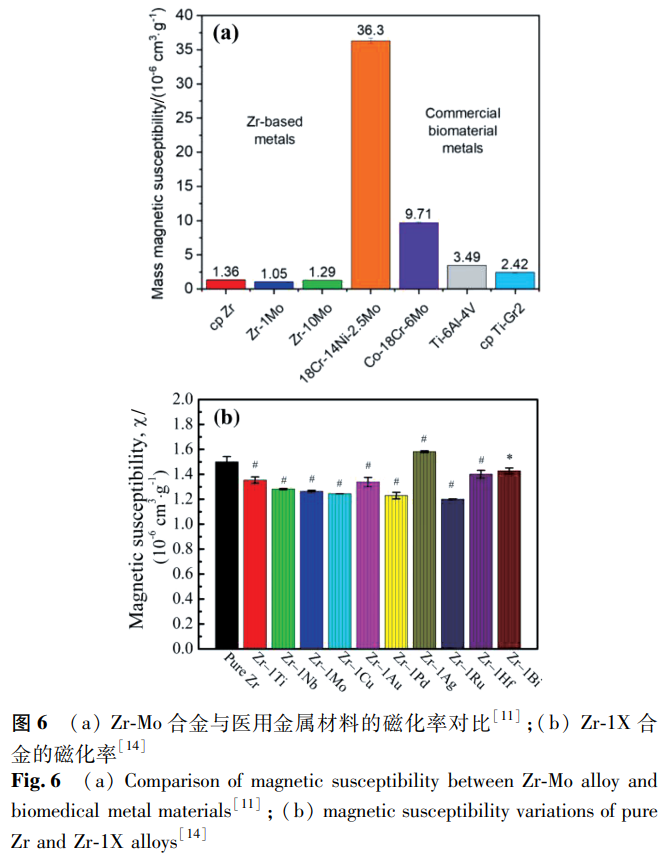
随着 MRI 技术在骨科和脑外科诊断中的广泛应用,医用金属材料的磁性能受到越来越多的关注。由高磁化率(χ)的不锈钢、钴铬合金、钛合金制成的植入物在 MRI 仪器的强磁场中会被磁化,导致植入物发热、移位,甚至产生图像伪影 [71]。部分 Zr 合金的磁化率如图 6 所示。对比来看,Zr 合金的磁化率大多数低于 2.0×10⁻⁶cm³/g,明显低于目前商用的各类医用金属材料,具有一定的应用前景。Zr 合金的磁化率与相组成有关,Nomura 等 [25] 研究发现 Zr-xNb 合金的磁化率低于纯 Ti 和 Ti-6Al-4V 合金,相组成对磁化率的影响规律为 χ_β>χ_(α')>χ_α,在 Zr-Mo 二元合金中也发现了类似的规律 [35]。Collings 等 [72] 报道称,磁化率取决于组成相及其体积分数,可表示为:

式中:V_α、V_β 和 V_ω 分别是 α 相、β 相和 ω 相的体积分数;χ_(α')、χ_β 和 χ_ω 是每个对应相的磁化率。
因此,通过控制合金的相组成可以起到调控合金磁化率的作用。需要注意的是 ω 相虽然具有低磁化率,但是一种硬脆相,占比过多的 ω 相会导致合金延展性变差,因此对低磁化率 Zr 合金的设计还需要综合考虑多方面的因素。
3、医用锆合金的表面改性
目前,生物医用金属材料在应用中普遍面临的问题是生理环境中的腐蚀所造成的金属离子向周围组织扩散及植入材料自身性质的退变,前者可能导致毒害作用,后者可能导致植入失效 [48]。在复杂的体液环境下,金属材料的腐蚀和磨损是植入物失效的主要原因。据报道 [73-74],高达 80% 的关节假体返修手术都是磨损引起的植入假体松动导致的。因此,为了延长植入物寿命,采用表面改性技术改变材料表面的化学成分或组织结构以提高材料耐磨和耐腐蚀性能十分重要。目前表面改性技术已广泛用于材料的表面处理,使医用金属材料得到了极大的发展。Zr 合金是很有潜力的植入物材料,但由于其硬度低、耐磨性差而在人工关节材料的应用中受到限制 [75],对其进行表面改性有利于拓展新型 Zr 基合金植入物的应用。
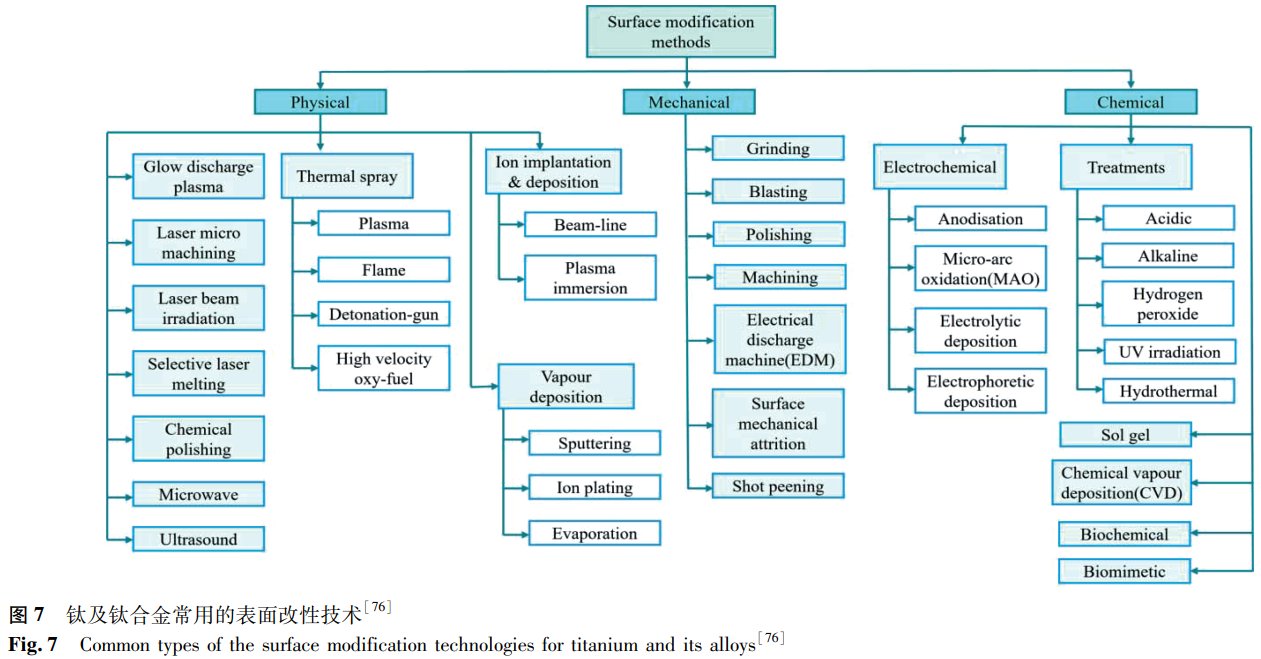
为了提高合金的表面性能,使其满足生物医用要求,人们开发了多种表面改性技术,主要分为物理方法、化学方法和机械方法。图 7 [76] 给出了钛及钛合金常用的表面改性技术,如热喷涂、磁控溅射、气相沉积、离子注入等,这为 Zr 合金的表面改性研究提供了宝贵的经验。相比之下,生物医用 Zr 合金的表面改性研究起步较晚,但从已有的初步探索及核用 Zr 合金的经验来看,表面处理技术对 Zr 合金的性能提升效果显著。Liu 等 [77] 采用等离子体渗氮(PN)与激光表面织构(LST)技术相结合的方法在 Zr-2.5Nb 合金表面制备微织构氮化层,发现合金的耐磨性与 LST 和 PN 处理的顺序有关,且采用 LST/PN 复合技术在 Zr-2.5Nb 合金表面制备的氮化层(Zr₃N₄和 ZrN 相)具有最高的显微硬度和最低的磨损率。Li 等 [78] 利用阳极氧化技术在 Zr-17Nb 合金表面制备了高度有序的氧化物纳米管阵列,膜层主要由正交相的 ZrO₂和 Nb₂Zr₆O₁₇组成,显著降低了合金的杨氏模量与硬度,提高了合金的亲水性,更有利于体液的浸润。Farina 等 [79] 采用同样的表面处理方法,比较了纯 Zr 和 Zr-2.5Nb 的耐腐蚀性能,发现阳极氧化后二者均获得了更高的耐腐蚀性能,且合金比纯 Zr 表现更加优异。此外,微弧氧化 [80]、等离子体电解氧化 [81]、热氧化 [82]、超声冲击强化 [83] 等技术也被证实能有效提高 Zr 合金的性能。
为了解决人工关节、牙种植体等部位面临的磨损与腐蚀双重问题,研究人员采用表面改性技术开发了几种硬质涂层,如氮化钛(TiN)、氮化钛铌(TiNbN)、类金刚石碳(DLC)、二氧化钛(TiO₂)、氧化锆(ZrO₂)和 TB-TiN 金属基复合涂层等,这些陶瓷涂层均具有良好的体外耐磨性和生物相容性。但金属表面硬陶瓷涂层的长期稳定性往往取决于涂层与基体的界面特性,如界面的锐度、结合强度以及涂层与基体材料的相互扩散。而原位生长的氧化物或氮化物层与基底有很强的附着力,不易发生分层或灾难性断裂,可以提供比外部沉积涂层更好的界面特性,从而确保这些耐磨涂层的长期稳定性。例如,美国 Smith and Nephew 公司在 500℃空气中对 Zr-2.5Nb(ASTM F2384-10)合金进行热氧化处理,制备了 5-6μm 厚的表面氧化锆层,称之为黑晶(Oxinium),并先后应用于全膝关节置换术(TKR)和全髋关节置换术(THR)[11,84]。与 Co-Cr 和 Ti 合金相比,该预氧化合金表面具有更高的硬度和更优良的耐磨性,在体外测试中,预氧化后的 Zr-2.5Nb 球头比 Co-Cr 股骨头产生的聚乙烯磨损颗粒更少 [85]。Good 和 Kim 等 [86-87] 比较了预氧化 Zr-2.5Nb 球头和 Co-Cr 股骨头在临床条件下的磨损情况,发现预氧化的 Zr-2.5Nb 球头使磨损颗粒的数量减少了 4 倍,证明预氧化 Zr-2.5Nb 球头能有效延长临床植入物的寿命。此外,Reger 等 [88] 对激光加工的纯 Zr 进行热氮化处理,得到 5-26μm 厚的陶瓷表面层,其由 ZrN、Zr₂N、ZrO₂和 Zr₇O₅N₄组成;热氮化处理后的纯 Zr 硬度在 492HV-1365HV,在模拟体液中对 Al₂O₃的耐磨性极大提高,比未处理的纯 Zr 的体积磨损率降低了 3 个数量级,其中经 800℃/6h 的渗氮处理后,Zr 的耐腐蚀和耐磨损性能最好。Luo 等 [75] 在空气中对 Zr-2.5Nb 合金进行热氧化实验,发现一定温度和时间下的热氧化处理提高了 Zr-2.5Nb 合金的表面硬度和耐磨性,但随着温度升高,氧化层(以 m-ZrO₂为主)厚度也增加,由体积膨胀引起的内应力导致了氧化层逐渐出现孔隙和裂纹。Zhou 等 [57] 对 Zr-3Sn 合金在 600℃/3h 下进行热氧化处理,发现合金表面形成了致密的氧化层,该氧化层主要为 m-ZrO₂,使合金耐腐蚀性能与耐磨性得到提高。Zhang 等 [58] 在 600-700℃氧化处理 Zr-20Nb-Ti(x=0,3)合金,发现氧化层由大量的 m-ZrO₂、6ZrO₂-Nb₂O₅和少量的 t-ZrO₂组成,合金耐腐蚀性能与耐磨性均大幅度提高。
ZrO₂是一种生物惰性陶瓷,其生物相容性及与骨组织的结合状况和氧化铝(Al₂O₃)相似 [89],断裂韧性约为 Al₂O₃陶瓷的 2 倍,断裂强度为后者的 2-4 倍。由于具有优良的生物相容性、良好的断裂韧性、高的断裂强度和低的弹性模量,ZrO₂陶瓷已临床应用于全髋置换术和全膝置换术,且在牙科领域被广泛应用于种植体、种植基台和全陶瓷牙冠,是主要的牙科修复体选择之一。因此,在面对复杂的人体生理环境时,在 Zr 合金植入物表面原位生长得到的坚硬稳定的氧化锆陶瓷具有较大的应用前景。但对 Zr 合金来说,目前通过表面改性提高合金性能并将其用于生物医学领域的研究还较少,研发新工艺、新涂层并进一步探究植入物表面与人体细胞的相互作用是研究的新方向。即便是目前较成熟的临床医学植入物 —— 钛及钛合金,单一的涂层制备工艺也很难满足多种医学性能的要求,多种复合涂层制备工艺协同作用才是未来的趋势。此外,在针对一些结构复杂的部件(如人工髋关节、膝关节)时,制备工艺的简便性、经济性也是大规模生产应用时需要重点考虑的问题。
新涂层的探索也很有必要,除了传统的耐蚀耐磨涂层外,表面抗菌涂层、生物活性涂层等的研究也是拓宽 Zr 及其合金应用领域的关键。目前大多数抗菌涂层都是通过释放杀菌物质来实现抗菌,并且为了避免耐药菌株的出现,主要通过添加 Ag、Cu、Zn 等金属元素来起到持续的杀菌效果,这在 Ti 合金表面抗菌涂层上已有大量研究,而针对 Zr 合金相关的抗菌涂层制备及抗菌性的强弱还需要大量的实验验证。生物活性涂层也是近年来研究的热点,目前研究最多、应用最广泛的生物活性涂层是羟基磷灰石(Ca₁₀(PO₄)₆(OH)₂,HA)及其复合涂层 [90]。羟基磷灰石是人体和动物骨骼的主要无机成分,具有良好的生物相容性、骨传导性以及骨诱导性,能够与骨组织紧密结合且会逐渐降解产生 Ca²⁺和 PO₄³⁻,最后被人体吸收利用长出新的骨组织 [91]。Singh 等 [92] 采用等离子喷涂在 β 相 Ti-35Nb-7Ta-5Zr 髋关节假体合金上沉积一层致密无裂纹的 HA-TiO₂涂层,增强了合金耐腐蚀性能和生物活性,涂层表面形成磷灰石,促进了合金与骨组织的化学整合。Rafieerad 等 [93] 采用电泳沉积法在 Ti-6Al-7Nb 合金表面制备了 HA-ZrO₂复合涂层,该涂层表现出超亲水性,且在培养 5d 后诱导了模拟体液中磷灰石的生成,提高了细胞相容性。虽然涂层的生物活性得到显著提高,但是涂层与基材热膨胀系数的差异会导致较大的残余应力,限制界面结合强度,同时涂层的生物活性与稳定性往往此消彼长,如何制得致密无裂纹、厚度均匀、与基体结合力强的 HA 涂层及 HA 复合涂层仍具有一定的挑战性。总的来说,Zr 合金及其表面涂层的研究起步较晚,但通过借鉴目前已商用 Ti 合金的成熟经验,设计出合理的多功能涂层,有希望在现有研究的基础上实现新的跨越,获得性能优异的医用 Zr 合金。
4、结语与展望
Zr 合金可以满足新型骨科植入物材料大部分的性能要求,包括生物相容性、强度、延展性、模量、耐腐蚀性能和耐磨性,且适用于 MRI 诊断,将有广阔的应用前景。目前,大部分研究主要通过改变合金成分和制备加工方法来得到不同的相组成,从而调控合金的性能,研究的方向逐渐从以 Zr-Nb、Zr-Mo 和 Zr-Ti 系为主的二元合金走向多元合金,从关注材料单一的低模量到考虑合金适配的力学性能、耐腐蚀性能与生物相容性协同发展。此外,为了缩短合金的研发周期,结合 d 电子理论、价电子浓度等合金设计理论和第一性原理计算与有限元分析方法可以为新型 Zr 合金体系的开发和工艺加工提供理论指导。在器件制备方面,3D 打印技术逐渐成为当前的热点,它可以针对不同患者的需求及医疗器件的结构复杂性进行定制化打印,效率高且具有高度的灵活性,将成为医用植入物金属材料的一个重要发展方向。
采用表面改性技术制备耐蚀耐磨涂层、生物活性涂层和表面抗菌涂层能够有效拓宽医用 Zr 合金的应用领域。通过借鉴医用 Ti 合金的经验可以帮助 Zr 合金实现表面改性技术的快速应用,且随着表面涂层的研究逐渐由单一膜层朝着多组元、多层复合涂层发展,采用新的表面改性技术及多种技术的复合来得到性能优异的多功能涂层是未来的重要发展趋势之一。在此基础上,在研究材料表面抗菌性、建立 Zr 合金表面生物活性评价体系、解决涂层与基体的界面稳定性的同时,进一步改善合金表面的生物性与生物力学性能,是未来 Zr 及其合金表面功能涂层研究的重要方向。
参考文献
[1] Li C L, Zhan Y Z, Jiang W P. Materials & Design, 2011, 32, 4598.
[2] Sumita M, Hanawa T, Ohnishi I, et al. Comprehensive Structural Integrity, 2003, 4, 131.
[3] Wang C T, Ge S R, Jin Z M. The engineering of orthopedic implants, Shanghai Jiao Tong University Press, China, 2016, pp. 355 (in Chinese).
王成焘,葛世荣,靳忠民。骨科植入物工程学,上海交通大学出版社,2016, pp. 355.
[4] Ren J S, Zhang Y M, Tan J, et al. Materials Reports, 2016, 30 (S2), 384 (in Chinese).
任军帅,张英明,谭江,等。材料导报,2016, 30 (S2), 384.
[5] Wei C X, Luo L Y, Wu Z X, et al. Journal of the Mechanical Behavior of Biomedical Materials, 2020, 111, 104017.
[6] Okazaki Y, Sethumadhvan R, Yoshimasa I, et al. Biomaterials, 1998, 19 (13), 1197.
[7] Lopez M F, Jimenez J A, Gutierrez A. Electrochimica Acta, 2003, 48 (10), 1395.
[8] Sumner D R, Turner T M, Igloria R, et al. Journal of Biomechanics, 1998, 31, 909.
[9] Geetha M, Singh A K, Asokamani R, et al. Progress in Materials Science, 2009, 54, 397.
[10] Okazaki Y. Biomaterials, 2002, 23, 2071.
[11] Suzuki A K, Campo K N, Fonseca E B, et al. Scientific Reports, 2020, 10, 2621.
[12] Yoshiaki I, Kazuhiro T, Equo K, et al. Materials Transactions, 2005, 46, 2260.
[13] Hobbs L W, Rosen V B, Mangin S P, et al. International Journal of Applied Ceramic Technology, 2005, 2 (3), 221.
[14] Zhou F Y, Qiu K J, Li H F, et al. Acta Biomaterialia, 2013, 9 (12), 9578.
[15] Liu J Z. Nuclear structural materials, Chemical Industry Press, China, 2007, pp. 192 (in Chinese).
刘建章。核结构材料,化学工业出版社,2007, pp. 192.
[16] Kobayashi E, Doi H, Yoneyama T, et al. Journal of the Japanese Society for Dental Materials and Devices, 1995, 14 (3), 321.
[17] Zhang Y M, Guo T W, Li Z C. West China Journal of Stomatology, 1999, 17 (4), 329 (in Chinese).
张玉梅,郭天文,李佐臣。华西口腔医学杂志,1999, 17 (4), 329.
[18] Grandin H M, Berner S, Dard M. Materials, 2012, 5 (8), 1348.
[19] Al-Nawas B, Bragger U, Meijer H J, et al. Clinical Implant Dentistry and Related Research, 2012, 14 (6), 896.
[20] Barter S, Stone P, Bragger U. Clinical Oral Implants Research, 2012, 23, 873.
[21] Chiapasco M, Casentini P, Zaniboni M, et al. Clinical Oral Implants Research, 2012, 23 (10), 1136.
[22] Guglielmotti M B, Renou S J, Cabrini R L. International Journal of Oral & Maxillofacial Implants, 1999, 14 (4), 565.
[23] Tsutsumi Y, Nishimura D, Doi H, et al. Materials Science & Engineering C, 2009, 29 (5), 1702.
[24] Branzoi I V, Iordoc M, Branzoi F. Key Engineering Materials, 2009, 415, 13.
[25] Nomura N, Tanaka Y, Suyalatu, et al. Materials Transactions, 2009, 50 (10), 2466.
[26] Kondo R, Nomura N, Suyalatu, et al. Acta Biomaterialia, 2011, 7, 4278.
[27] Zhou F Y, Wang B L, Qiu K J, et al. Materials Science & Engineering C, 2012, 32, 851.
[28] Kondo R, Shimizu R, Naoyuki N, et al. Acta Biomaterialia, 2013, 9, 5795.
[29] Zhao X L, Li L, Niinomi M, et al. Acta Biomaterialia, 2017, 62, 372.
[30] Nie L, Zhan Y Z, Hu T, et al. Journal of the Mechanical Behavior of Biomedical Materials, 2014, 29, 1.
[31] Xue R H, Wang D, Yang D W, et al. Materials, 2013, 13, 5130.
[32] Wang M K, Yuan J H, Liu Y F, et al. Acta Metallurgica Sinica, 2021, 57 (1), 95 (in Chinese).
王明康,苑峻豪,刘宇峰,等。金属学报,2021, 57 (1), 95.
[33] Rosalbino F, Maccio D, Giannoni P, et al. Journal of Materials Science: Materials in Medicine, 2011, 22, 1293.
[34] Liang J S, Liu L B, Xu G L, et al. Calphad, 2017, 56, 196.
[35] Suyalatu, Nomura N, Oya K, et al. Acta Biomaterialia, 2010, 6 (3), 1033.
[36] Suyalatu, Kondo R, Tsutsumi Y, et al. Acta Biomaterialia, 2011, 7, 4259.
[37] Zhou F Y, Wang B L, Qiu K J, et al. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2013, 101B (2), 237.
[38] Nie L, Zhan Y Z, Liu H, et al. Materials & Design, 2014, 53, 8.
[39] Guo S, Shang Y, Zhang J S, et al. Journal of Alloys and Compounds, 2018, 754, 232.
[40] Hsu H C, Wu S C, Sung Y C, et al. Journal of Alloys and Compounds, 2009, 488, 279.
[41] Wei C X, Luo L Y, Wu Z X, et al. Journal of the Mechanical Behavior of Biomedical Materials, 2020, 111, 104017.
[42] Wang D, Liu L B, Xue R H. Materials Science and Engineering of Powder, 2021, 26 (2), 125 (in Chinese).
王东,刘立斌,薛人豪,等。粉末冶金材料科学与工程,2021, 26 (2), 125.
[43] Kim T I, Han J H, Lee I S, et al. Bio-medical Materials and Engineering, 1997, 7 (4), 253.
[44] Shibutani H, Morinaga M, Kikuchi K. Atomic Energy Society of Japan, 1998, 40 (1), 70.
[45] Afrin M, Song T, Wei X, et al. Advanced Engineering Materials, 2018, 20 (9), 1800207.
[46] Bachtar F, Chen X, Hisada T. Medical & Biological Engineering & Computing, 2006, 44, 643.
[47] Frost H M. The Angle Orthodontist, 2004, 74 (1), 3.
[48] Lyu J, Cheng J, Hou X B. Introduction to biomaterials, Tongji University Press, China, 2016, pp. 23 (in Chinese).
吕杰,程静,侯晓蓓。生物医用材料导论,同济大学出版社,2016, pp. 23.
[49] Kuncicka L, Kocich R, Lowe T C. Progress in Materials Science, 2017, 88, 232.
[50] Kim M, An S, Huh C, et al. Applied Sciences, 2019, 9, 5281.
[51] Chui P F. Vacuum, 2017, 143, 54.
[52] Zhou F Y, Qiu K J, Bian D, et al. Journal of Materials Science & Technology, 2014, 30 (4), 299.
[53] Nie L, Zhan Y Z, Liu H, et al. Materials Science & Engineering C, 2013, 33, 5105.
[54] Guo S, Zhang J M, Shang Y, et al. Journal of Alloys and Compounds, 2018, 745, 234.
[55] Xue G L, Yang H L, Xing H X, et al. Journal of Central South University, 2020, 27, 2185.
[56] Gu Q S, Hou C L, Xu Z. Practical biomedical materials science, Shanghai Science and Technology Press, China, 2005, pp. 182 (in Chinese).
顾其胜,侯春林,徐政。实用生物医用材料学,上海科学技术出版社,2005, pp. 182.
[57] Zhou F Y, Wang B L, Qiu K J, et al. Applied Surface Science, 2013, 265, 878.
[58] Zhang J F, Gan X X, Tang H Q, et al. Materials Science & Engineering C, 2017, 76, 260.
[59] Liu D Y, Zhan Y Z. Guangxi Sciences, 2018, 25 (6), 633 (in Chinese).
刘东云,湛永钟。广西科学,2018, 25 (6), 633.
[60] Niinomi M. The Journal of the Minerals, Metals & Materials Society, 1989, 51 (6), 32.
[61] Biesiekierski A, Wang J, Gepreel M, et al. Acta Biomaterialia, 2012, 8, 1661.
[62] Chen Q Z, Thouas G A. Materials Science & Engineering R-Reports, 2015, 87, 1.
[63] Oldani C, Dominguez A. Recent Advances in Arthroplasty, 2012, 218, 149.
[64] Niinomi M, Nakai M, Hieda J. Acta Biomaterialia, 2012, 8 (11), 3888.
[65] Calin M, Gebert A, Ghinea A C, et al. Materials Science & Engineering C, 2013, 33, 875.
[66] Zhang E L, Zhao X T, Hu J L, et al. Bioactive Materials, 2021, 6 (8), 2569.
[67] Mahmoudi P, Akbarpour M R, Lakeh H B, et al. Materials Today Bio, 2022, 17, 100447.
[68] Yu J Y, Yang X X, Zhan D S, et al. Chinese Journal of Materials Research, 2021, 35 (11), 873 (in Chinese).
于佳莹,杨希祥,战德松,等。材料研究学报,2021, 35 (11), 873.
[69] Taipina M O, Mello M G, Tamborlin L, et al. Materials Chemistry and Physics, 2021, 261, 124192.
[70] Fu S, Zhang Y, Yang Y, et al. Journal of Materials Science & Technology, 2022, 119, 75.
[71] Bui F M, Bott K, Mintchev M P. Journal of Medical Engineering & Technology, 2000, 24 (1), 20.
[72] Collings E W. Metallurgical and Materials Transactions A, 1979, 10A, 463.
[73] Mattei L, Di Puccio F, Piccigallo B, et al. Tribology International, 2011, 44, 532.
[74] Gremillard L, Martin L, Zych L, et al. Acta Biomaterialia, 2013, 9, 7545.
[75] Luo Y, Yang T, Rao X, et al. International Journal of Advanced Manufacturing Technology, 2018, 96, 1539.
[76] Alipal J, Mohd P N, Nayan N, et al. Materials Today: Proceedings, 2021, 42 (1), 270.
[77] Liu Y Y, Yang Y L, Dong D Y, et al. Journal of Engineering, 2020, 20, 100638.
[78] Li L, Yao S L, Zhao X L, et al. Acta Metallurgica Sinica, 2019, 55 (8), 1008 (in Chinese).
李玲,姚生莲,赵晓丽,等。金属学报,2019, 55 (8), 1008.
[79] Farina S B, Sanchez A G, Cere S. Procedia Materials Science, 2015, 8, 1166.
[80] Wang S, Guo F, Bai H R, et al. Rare Metal Materials and Engineering, 2010, 39 (4), 739 (in Chinese).
王双,郭锋,白海瑞,等。稀有金属材料与工程,2010, 39 (4), 739.
[81] Chen Y, Nie X, Northwood D O. Surface & Coatings Technology, 2010, 205 (6), 1774.
[82] Reger N C, Balla V K, Das M, et al. Surface & Coatings Technology, 2018, 334, 357.
[83] Mordyuk B N, Karasevskaya O P, Prokopenko G I. Materials Science & Engineering A, 2013, 559, 453.
[84] Ratner B D, Hoffman A S, Schoen F J, et al. Biomaterials science: an introduction to materials in medicine, Elsevier Press, Netherlands, 2004, pp. 537.
[85] Good V, Ries M, Barrack R L, et al. Journal of Bone & Joint Surgery, 2003, 85, 105.
[86] Good V, Widding K, Hunter G, et al. Materials in Engineering, 2005, 26 (7), 618.
[87] Kim Y H. Journal of Bone & Joint Surgery, 2005, 87 (8), 1769.
[88] Reger N C, Vamsi K B, Mitun D, et al. Surface & Coatings Technology, 2018, 334, 357.
[89] Brunski J B. Clinical Materials, 1992, 10, 153.
[90] Bai X H, Fan L, Zhao M Y, et al. Titanium Industry Progress, 2022, 39 (3), 33 (in Chinese).
白雪寒,范林,赵铭钰,等。钛工业进展,2022, 39 (3), 33.
[91] Hsu H C, Wu S C, Yang C H, et al. Journal of Materials Science: Materials in Medicine, 2009, 20, 615.
[92] Singh S, Prakash C, Singh H. Surface & Coatings Technology, 2020, 398, 126072.
[93] Rafieerad A R, Bushroa A R, Nasiri-Tabrizi B, et al. Advances in Applied Ceramics, 2017, 116 (6), 293.
tag标签:医用锆基合金



